为进一步加强药品检查信息公开,提高检查工作透明度,国家药品监督管理局对2017年国家开展的药品注册生产现场检查、药品GMP跟踪检查、药品飞行检查、进口药品境外生产现场检查、药品流通检查、国际药品GMP观察检查等工作情况进行汇总、统计和分析,2018年6月8日,发布《2017年度药品检查报告》。
2017年度药品检查报告(节选)
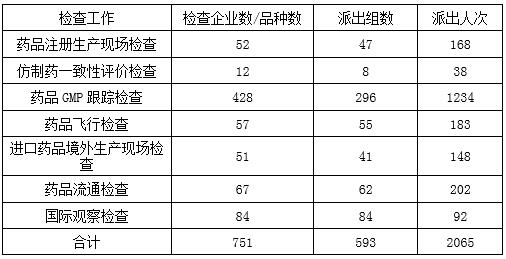
2017年原国家食品药品监督管理总局组织开展药品注册生产现场检查、仿制药一致性评价现场检查、药品GMP跟踪检查、飞行检查、进口药品境外生产现场检查、流通检查及国际观察检查共计751项。
2017年完成各类药品检查任务一览表
进口药品境外生产现场检查
一、检查基本情况
2017年原国家食品药品监督管理总局共派出41个检查组148名检查员完成了51个品种的进口药品境外生产现场检查任务。
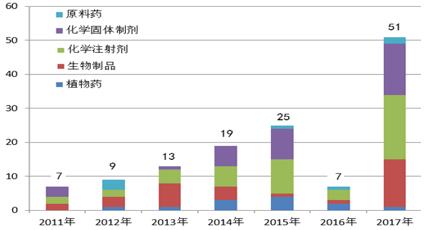
图4-1 2011年-2017年境外检查执行数量
2017年境外检查品种剂型较多,其中加大了对化学药品制剂延伸检查力度。全年任务中包括化学药品36个,含注射剂、固体制剂、粉雾剂、原料药等,疫苗、血液制品、治疗用生物制品14个,植物药1个。全年境外检查药品包括申报生产、再注册、补充申请阶段及正常进口销售的产品。主要集中在欧洲、北美地区,对印度等国家的检查数量呈增长趋势。
二、发现的主要问题
对51个开展现场检查的品种中,9个品种现场检查结论为不符合药品GMP要求或不通过,根据产品处于的不同阶段(上市前审评或已上市),都已经分别进行了处理。8个未开展现场检查的品种中,6个品种企业已主动采取风险控制措施,其余的列入到下年度检查计划中。
检查共发现缺陷项665项,其中严重缺陷27项,主要缺陷140项。问题主要集中在质量控制与质量保证、文件管理、无菌药品管理等方面。严重缺陷主要包括生产工艺不一致、重大变更未及时向我国申报,注册申报资料存在真实性问题,生产厂房设施、设备和生产操作行为等不能有效降低产品污染或混淆的风险,不能对不合格产品进行有效控制等方面。
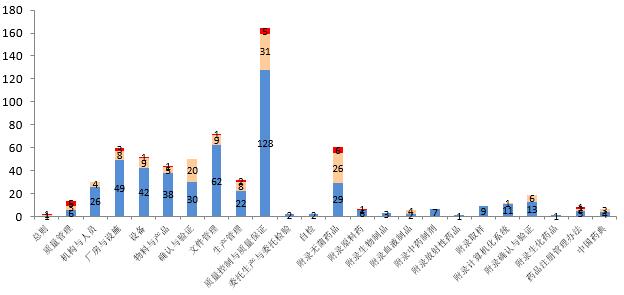
图4-2 2017年境外检查缺陷分布情况
(摘自:国家药品监督管理局网站 2018-06-08)



 首页
首页 最新动态
最新动态 机构简介
机构简介 国际交流
国际交流 关于我们
关于我们 京公网安备 11010802027110号
京公网安备 11010802027110号