2016年、国家食品医薬品監督管理総局(以下「総局」と略称)は「医療機器監督管理条例」を徹底的に実施し、「国務院による医薬品と医療機器審査承認制度改革の意見」(国発〔2015〕44号)に基づき、医療機器審査承認制度改革を引き続き深いレベルまで推進し、全国医療機器登録業務に対する監督と管理をより強化し、現場検査とデータ信憑性関係抜取検査に注力し、医療機器登録審査と承認の品質と能率を高めつづけてきた。
一、医療機器登録業務の実施状況
(一)医療機器登録管理法規システムの整備
「医療機器臨床試験品質管理規範」(国家食品医薬品監督管理総局、中華人民共和国衛生と計画生育委員会令第25号)、「医療機器一般名称命名規則」(国家食品医薬品監督管理総局令第19号)、「医療機器優先審査実施手順」(国家食品医薬品監督管理総局広告2016年168号)、「臨床試験免除第二類医療機器目録(第二回)」と「臨床試験免除第三類医療機器目録(第二回)」(国家食品医薬品監督管理総局通告2016年第133号)を発表した。
上記規定と規範類文書の制定と修正は我国医療機器登録管理法規システムが逐次に整備していることを意味し、医療機器登録管理に制度的保障を提供すると同時に、医療機器登録が秩序正しく行われるよう堅実な制度的基礎を築いた。
(二)医療機器審査承認制度改革の持続的深化
2016年、総局は医療機器審査承認改革オフィスを設立し、2016年改革任務の割当表を作成し、改革への督促と指導を行い、各改革を秩序正しく推進した。
1、総局医療機器技術審査センターは審査品質管理体制を確立し、「医療機器登録審査品質管理規範」を発表して実施し、各プロジェクト?チームの審査範囲を拡大させ、登録延長申請の審査を単独に序列を設け、登録延長申請の審査要求を規範化させ、意見交換制度を改善し、専門家の問い合わせ対応を規範化させ、審査の能率を高めた。
2、審査承認改革に関する要求事項に従い、分類管理改革を推し進め、「医療機器分類目録(意見募集用原稿)」を仕上げ、関係意見を募集し、医療機器分類技術委員会のもとで各専門チームを立ち上げる準備をした。
3、医療機器標準の制定と修正を積極的に促進し、「医療用電気設備 第2部分:軽イオンビーム医療用設備のセーキュリティと基本性能に関する要求事項」など106項目医療機器業界標準制定プロジェクトを立ち上げ、外科用インプラント、消毒設備など250項目医療機器業界標準を審査したうえで発表した。そのうち、強制タイプ標準は48項目、推薦タイプ標準は202項目で、修正説明は1項目だった。
4、第二回臨床試験免除医療機器目録を発表し、267種類の第二類医療機器、92種類の第三類医療機器、合計359種類の医療機器類製品の臨床試験を免除した。そのうち、15種類は体外診断用試薬で、体外診断用試薬が臨床試験免除目録に入ったのが今回で初めてである。
5、臨床試験データ信憑性に関係抜取検査にさらに注力した。医療機器臨床試験に対する監督と検査を2回も実施し、20社の企業による20件の登録申請を選出し、それらの申請にかかわる40カ所の臨床試験機構に対する検査を行った。その結果、8件の信憑性問題が存在する登録申請に対し、登録不許可とし、且つ不許可日から起算して1年以内に同申請を再度受理しないこととした。また、122社の企業は自主的に263件の医療機器登録申請を撤回した。省級食品医薬品監督管理局(以下「省局」と略称)は積極的に第二類医療機器臨床試験に対する監督と検査を行った。
現場査察の実施を通して、申請者と臨床試験機構の法律意識、信用意識、責任意識と品質意識を高め、医療機器臨床試験の実施過程を規範化させ、ねつ造と改ざんを取り締まり、警鐘を鳴らした。
6、各省級医薬品監督管理機関は、各省の審査承認能力を引き続き向上させ、審査承認制度の改革を推し進めた。一部の省局はイノベーション等の特殊第二類医療機器に対し、優先審査実施方法を制定し、第二類医療機器登録プロセスを最適化、簡素化し、14の省で登録費用徴収制度を実施した。
7、2016年12月29日、「一部医療機器関係行政審査承認手順の調整に関する決定」(意見募集用原稿)を作成し、関係意見を募集した。
(三)医療機器登録業務に対する監督管理の強化
2016年、磁気治療製品、歯科インプラント(システム)、吸収性縫合糸など52件の医療機器登録技術審査指導原則を制定、修正した。そのうち、制定したものは30件で、修正したものは22件だった。医療機器類製品の発展実態を踏まえたうえ、「医療機器関係インターネット?セーキュリティ技術指導原則」を発表し、関係審査要求事項を統一化させ、製品安全性と有効性審査の水準を高めた。それと同時に、33件の医療機器登録技術審査指導原則の作成計画を立てた。
各省の医療機器審査承認能力に関する評価を引き続き行い、審査承認能力認定指標を改善し、各省による自主チェックを基礎とし、10カ所の省局に対する考査を行った。考査の際に、書類を選出して現場審査を実施し、よく発覚される問題をまとめて分析し、省級食品医薬品監督管理機関の医療機器登録管理水準の向上を促進した。
二、医療機器登録申請の受理状況
2016年、総局は合計8920件の医療機器登録、登録延長と許可事項変更審査を受理し、そのうちの登録申請受理件数は登録審査2015年と比べて5.1%減少した。
(一)全体状況
2016年、受理した国産第三類医療機器登録申請は3007件、受理した輸入医療機器登録申請は5913件だった。
品目によって分類すれば、医療機器登録申請は5920件、体外診断用試薬登録申請は3000件だった。
申請類別によって分類すれば、初回登録申請は1612件で全体の18%を占め、登録延長申請は5402件で全体の61%を占め、許可事項変更申請は1906件で全体の21%を占めた。内訳は図1を参照するように。
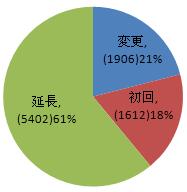
図1 申請類別の比例図
(二)類別状況
1、国産第三類医療機器登録申請の受理状況
2016年、受理した国産第三類医療機器登録申請は合計3007件で、2015年と比べて23%減少した。そのうち、医療機器登録申請は1899件、体外診断用試薬登録申請は1108件だった。
登録類別をみれば、初回登録申請は864件で全体の29%を占め、登録延長申請は1622件で全体の54%を占め、許可事項変更申請は521件で全体の17%を占めた。

図2 国産第三類医療機器登録申請各類別比例図
2、輸入第二類医療機器登録申請の受理状況
2016年、受理した輸入第二類医療機器登録申請は3095件で、2015年と比べて2%増加した。そのうち、医療機器登録申請は1690件、体外診断用試薬登録申請は1405件だった。
申請類別をみれば、初回登録は449件で全体の15%を占め、登録延長は2012件で全体の65%を占め、許可事項変更は625件で全体の20%を占めた。内訳は図3を参照するように。

図3 輸入第二類登録申請各類別比例図
3、輸入第三類医療機器登録申請の受理状況
2016年、受理した輸入第三類医療機器登録申請は2818件で、2015年と比べて15%増加した。そのうち、医療機器登録申請は2331件、体外診断用試薬登録申請は487件だった。
申請類別をみれば、初回登録は299件で全体の11%を占め、登録延長は1759件で全体の63%を占め、許可事項変更は760件で全体の16%を占めた。内訳は図4を参照するように。
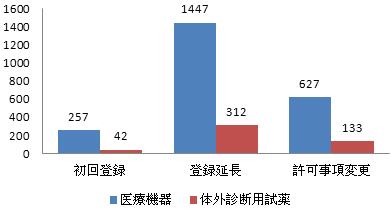
図4 輸入第三類登録申請各類別比例図
三、医療機器登録審査承認の状況
2016年、総局は合計9336件の医療機器登録申請関係技術審査を完了し、2015年と比べて0.25%増加した。そのうち、初回登録関係は2427件、登録延長関係は5276件、許可事項変更関係は1633件だった。2016年年末まで、審査中の申請は5598件で、そのうち、資料追加提出通知書発行済みで提出待ちのものは2247件だった。
2016年、総局が承認した医療機器登録、登録延長と許可事項変更申請は合計8653件で、2015年と比べて14.9%増加した。
2016年、338件の医療機器登録申請に対し、不承認の決定を出した。企業が自ら撤回した医療機器登録申請は310件だった。潇洒·
ここ4年間、総局が承認した医療機器登録申請の件数については、図5を参照するように。
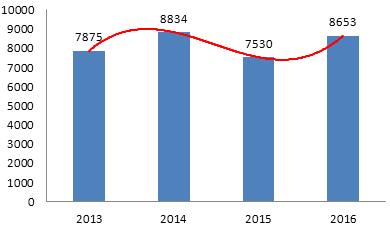
図5 2013-2016年登録申請件数
(一)全体状況
2016年、総局が承認した国産第三類医療機器登録申請は2902件で、2015年と比べて6%増加した。また、総局が承認した輸入医療機器登録申請は5751件で、2015年と比べて20%増加した。
品目によって分類すれば、医療機器は5506件、体外診断用試薬は3147件だった。両者の比例は7:4。
申請類別によって分類すれば、初回登録申請は1966件で全体の23%を占め、登録延長申請は5221件で全体の60%を占め、許可事項変更申請は1466件で全体の17%を占めた。内訳は図6を参照するように。
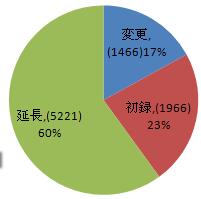
図6 2016年申請類別の比例図
(二)類別状況
1、国産第三類医療機器登録申請の審査承認状況
2016年、承認した国産第三類医療機器は合計2902件だった。そのうち、医療機器関係1661件、体外診断用試薬関係は1241件だった。
申請類別をみれば、初回登録は929件で全体の32%を占め、登録延長は1510件で全体の52%を占め、許可事項変更申請は463件で全体の16%を占めた。
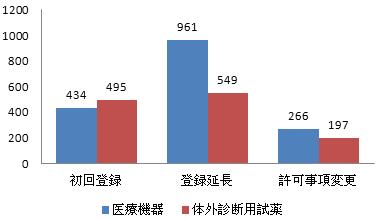
図7 国産第三類登録申請各種類比例図
2、輸入第二類医療機器登録申請の審査承認状況
2016年、承認した輸入第二類医療機器は3083件だった。そのうち、医療機器登録関係は1535件、体外診断用試薬登録関係は1548件だった。
申請類別をみれば、初回登録は444件で全体の14%を占め、登録延長は2077件で全体の68%を占め、許可事項変更は625件で全体の20%を占めた。内訳の詳細は図3を参照するように。

図8 輸入第二類登録申請各種類比例図
3、輸入第三類医療機器登録申請の審査承認状況
2016年、承認した輸入第三類医療機器は2668件だった。そのうち、医療機器登録申請は2255件、体外診断用試薬登録申請は413件だった。
登録類別をみれば、初回登録は593件で全体の22%を占め、登録延長は1634件で全体の61%を占め、許可事項変更は441件で全体の17%を占めた。各種類内訳は図9を参照するように。
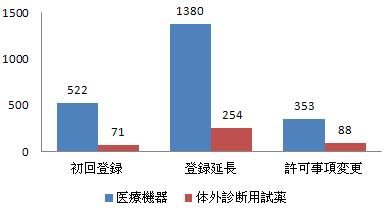
図9 許可された輸入第三類登録申請各種類比例図
(三)初回登録申請の月間承認状況
2016年、総局が承認した医療機器初回登録申請は合計1966件だった、月間承認状況については、図10を参照するように。

図10 2016年医療機器初回登録申請月間承認状況
(四)承認された品目に関する分析
承認の内訳をみれば、体外診断用試薬の承認は最も割合が高く、国産第三類医療機器全体の43%を占め、輸入第三類医療機器全体の33%を占めた。
2016年、承認した国産第三類医療機器は、体外診断用試薬を除くと、「医療機器分類目録」の28種類の製品にかかわった。
トップ5位はインプラントと人工器官類製品、医療用高分子材料および製品、注射用穿刺器具、医療用光学的機器?器具および内視鏡類設備、手術室、救急室と診療室用設備および器具だった。
2015年と比べて、インプラントと人工器官類製品は2位から1位に上がり、手術室、救急室と診療室用設備および器具はカテーテル類製品に代わってトップ5位に入った。
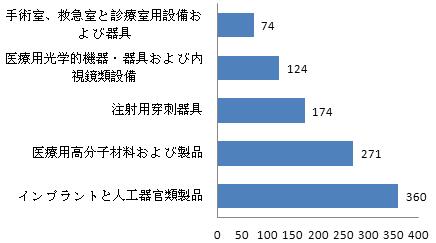
図11 承認した国産第三類医療機器品目ランキングのトップ5
2016年、承認した輸入医療機器は、、体外診断用試薬を除くと、「医療機器分類目録」の39種類の製品にかかわった。
トップ5位はインプラントと人工器官類製品、医療用光学的機器?器具および内視鏡類設備、医療用電子機器類設備、医療用高分子材料および製品、手術室、救急室と診療室用設備および器具だった。
2015年と比べて、国産第三類医療機器と同様に、インプラントと人工器官類製品は2位から1位に上がった。また、手術室、救急室と診療室用設備および器具は口腔用材料に代わってトップ5位に入った。

図12 登録許可取得済み輸入医療機器品目ランキングのトップ5
(五)輸入医療機器の国別分析
2016年、アメリカ、ドイツ、日本、イギリスと韓国産医療機器は中国で承認した輸入医療機器のトップ5位を占め、2015年と同様に、2016年の承認した輸入医療機器総量の73%を占めた。

図13 輸入医療機器国別ランキング
(六)国産第三類医療機器の省別分析
2016年、国産第三類医療機器の承認状況を省別にみれば、関係製品企業は主に沿海地域で、経済が発展している省に集中していた。
四、イノベーション医療機器などの審査承認状況(一部省略)
2016年、総局は「イノベーション医療機器特別審査承認手順(試行版)」も従い、イノベーション医療機器審査を引き続き実施し、一部のイノベーション医療機器類製品の上市を承認した。
2016年、総局は197件のイノベーション医療機器特別審査承認申請を受け付け、専門家を招へいし、そのうちの175件の申請を審査した。結果、審査完了申請は144件、特別審査実施申請は45件になった。また、心臓3 Dマッピングシステムなど10種類の製品の上市を許可した。そのうち、能動医療機器は6種類、非能動医療機器は3種類、体外診断用試薬は1種類、2015年と比べて1種類増えた。
それらのイノベーション製品に使用された核心的技術はいずれも我国で特許権を有し、もしくは特許申請中のもので、国務院特許管理部門によって公開されている。また、主な稼働原理と作動機序はいずれも国内初で発覚されたもので、顕著な臨床応用価値を有する。
五、その他登録管理の状況(省略)
(出所:CFDAサイト2017-03-27)



 ホーム
ホーム 最新情報
最新情報 機構紹介
機構紹介 国際交流
国際交流 サイトについて
サイトについて