2019年3月29日、国家医薬品監督管理局は、「中華人民共和国政府情報公開条例」の関係規定に基づき、「2018年政府情報公開業務年間報告書」を作成した。報告書の内容は概況、政府情報自主公開状況、申請によって政府情報を公開または公開しない状況、情報公開関係費用徴収および減免状況、情報公開関係行政不服審査または訴訟の状況、情報公開業務の主要問題と改善措置などである。本報告書のデータ統計期間は2018年1月1日から12月31日までである。
「2018年政府情報公開業務年間報告書」の抜粋は以下のとおりである。
一、概況
2018年、国家医薬品監督管理局は「中華人民共和国政府情報公開条例」、「国務院弁公庁による2018年政務公開要項発表の通達」に基づき、穏やかに進展をとげるという業務方針を堅持し、監管方式を革新し、制度の確立を促進し、重点分野関係情報の主動公開に注力し、政策説明と世論形成への指導に積極的に取り込み、注目されている問題の対処を速やかに行い、情報公開の幅を継続的に拡大させ、監管業務の透明度を高めた。
二、政府情報主動公開の状況
(一)情報公開制度の確立を促進すること。「国家医薬品監督管理局2018年政務公開業務実施方案」、「国家医薬品監督管理局政府サイト情報公開管理規則(試行版)」などの関係書類を制定して発布し、情報公開ガイドラインを同時に更新し、医薬品監管情報公開の計画、要項を明確化し、健全な情報公開制度を確立し、医薬品監管情報公開業務のクオリティと効果を高めた。
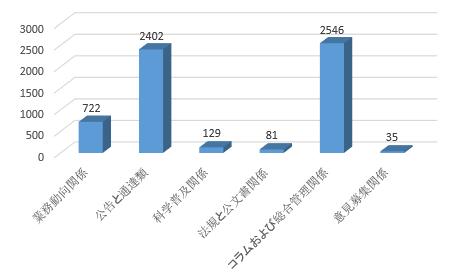
(二)サイトにおける情報主動公開に注力すること。2018年、国家医薬品監督管理局サイトで、5915件の情報が公開された。そのうち、業務動向関係情報が722件で12.2%を占め、公告と通達類が2402件で40.6%を占め、科学普及関係情報が129件で 2.2%を占め、法規と公文書関係情報が81件で1.4%を占め、コラムおよび総合管理情報が2546件で 43.0%を占め、意見募集関係情報が 35件で0.6%を占めた。また、サイトでは、80以上の情報公開項目、4つのコミュニケーション?ブロック、1つの行政許可サービスサブサイトが確立された。



(三)重点分野情報公開への注力
1、医薬品と医療機器審査承認情報の公開。行政相対人が速やかに審査承認の進捗状況を把握できるよう確保し、薬審センターのサイトで医薬品審査承認進捗状況を確認するためのルートを設立した。2018年、国民の医薬品安全使用を保障するために、48品目の新薬の上市申請を承認し、国家医薬品監督管理局に承認された医薬品の審査承認情報はいずれも医薬品監督管理局サイトのデータベースでチェックできる。オンライン上市済み医薬品目録システムを確立し、2018年には424品目を新規収録した。上市承認された医療機器に関する公告を毎月発表した。99件の医療機器業界標準の制定と修正を決定し、104件の医療機器業界標準を発布した。医療機器唯一標識システム規則を起草し、関係手順に従って元食品医薬品監管総局、市場監管総局と中国政府法制情報サイトで意見を募集し、WTO/TBT通達を行った。62件の医療機器技術審査ガイドラインを発布した。
2、医薬品監督検査と抜取検査情報の公開。医薬品メーカーへの追跡と無通告検査を実施し、検査でGMPに適合していないと発覚された企業に関して22件の追跡検査通報、4件の無通告検査結果通報、8件の通告を発表し、安徽広印堂漢方薬股フェン有限公司、長春長生生物科技有限責任公司などの企業の法律、規定違反行為に関する情報を公開した。医薬品経営企業年間検査計画を制定し、医薬品経営品質管理規則に違反した16社の企業への処罰を公開した。2018年7月23日から8月9日まで、全国各地にある45社のワクチンメーカーに対するリスク検査を徹底的に実施した。医薬品副作用年間報告書を発表した。2018年には、分析と評価の結果に基づき、12回の医薬品安全性情報管理状況速報を発表し、海外医薬品安全情報関係が59件だった。3回の医薬品市販中止公告を発表し、4品目医薬品の生産、販売と使用を中止し、33品目の医薬品添付文書を修正した。
「国家薬監局による医薬品輸出販売証明管理規定の通知」を発表し、我国の医薬品輸出に利便性とサービスを提供した。「医薬品と医療機器海外検査管理規定の公告」、「医薬品上市許可保有者による有害事象直接報告に関する公告」、「国家薬監局による医薬品集中調達と試行期間中監管に関する通達」を発表し、党中央、国務院による医薬品集中調達と試行業務の計画を実施した。「国家薬監局による医薬品情報化追跡システム確立ガイドライン」を発表し、全品目全過程をカバーする医薬品追跡システムの確立を推し進める。EU輸出原薬の証明書類に関する情報公開を引き続き推進し、輸出企業にサービスを提供すると同時に、情報共有の形で海外監管機関との協力を行った。2018年、「EU輸出原薬の証明書類関連情報システム」で、93件の新しい情報を発表した。
3、化粧品監督検査と抜取検査情報の公開。
4、医療機器監督検査と抜取検査情報の公開。2018年、94社の国内メーカーを対象に無通告検査を実施した結果、重篤欠陥が存在する21社のメーカーに対して生産停止と整頓改善を命じ、検査の状況と21社メーカーの生産停止通告がいずれも国家医薬品監管局のサイトで公開した。また、国家医薬品監管局サイトのリコール専用ブロックで、134件のリコール情報を公開し、そのうち、1級リコール情報が9件(1件の海外実施リコールを含む)、海外実施の医療機器2、3級リコールが125件だった。各省級監管局が発表し、国家医薬品監管局サイトのリンクでチェックできるリコール情報が499件だった。国家医薬品監管局サイトで公開されたリコール情報が633件で、医療機器の安全上リスクを有効的に排除し、医療機器の安全を保障した。2018年11月23日に国家医薬品監管局サイトで「医療機器の個人名義購買と使用に関する注意事項」を発表した。また、同サイトで国家医療機器監督と抜取検査結果を速やかに発表し、2回の公告と9回の通告を発表した。特に、抜取検査結果の発表を加速化し、その年に実施した検査の結果とその年に発表するよう実現した。
(四)全人代会議と政治協議会議での提案と意見への対応公開を穏やかに推進。
(五)政策と情報の説明と関係問い合わせ対応に注力。1つ目は上市済み医薬品目録集、ジェネリック医薬品一致性評価、HPVワクチン審査承認などの重点業務をめぐって各種広報活動を行い、監管機関の業務実施成果をアピールし、権威の声を速やかに伝え、国民が科学的に医薬品監管を理解するよう指導した。2018年、8回のニュースリリース会議(発表会、記者会見を含む)を開催し、国家医薬品監管局サイト(元食薬総局サイト、過渡期サイトを含む)で1.3万件以上の情報を公開した。2つ目はメディアとの協力を積極的に行い、ニュースリリースを自主的に行った。3つ目は科学普及と宣伝を引き続き実施し、国民の科学素養を高めた。4つ目は社会の注目が集まった問題に速やかに対応した。
(六)情報公開のプラットフォームを整備し、ニューメディアの運営とメンテナンスに注力。1つ目は国家医薬品監管局サイトというプラットフォームを確立した。国家医薬品監管局の過渡期サイトを確立し、同サイトが登録当日にオンラインし、穏健に稼働するよう確保した。国家医薬品監管局オフィシャルサイトのデザイン、開発、オンライン関係業務を同時に実施し、同サイトが2018年11月3日に正式にオンラインし、順調に稼働するよう実現できた。2つ目はニューメディアのニュースリリース機能を強化した。ウィーチャット、ウェイボーの管理機関と積極的にコミュニケーションし、国家医薬品監管局のウィーチャットアカウントの「中国薬聞」、ウェイボーアカウントの「中国薬品監管」などを開設し、これらのニューメディアのコンテンツも国家医薬品監管局サイトと同時に更新し、「両ウィ一端」の情報公開プラットフォームを確立し、その運営にも力を入れた。2018年、ウィーチャットアカウントの「中国薬聞」で1547件の記事が発表され、閲覧人数が580万人以上だった。ウェイボーアカウントの「中国薬品監管」で1437件の記事が発表され、閲覧人数が6806万人以上だった。
三、申請によって公開または公開しない政府情報の状況
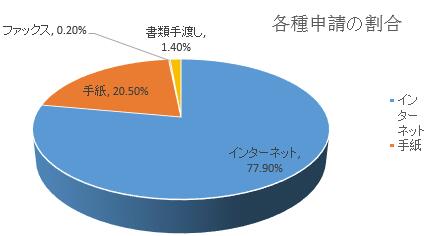
(一)申請状況。2018年、受理された有効情報公開申請が924件だった。そのうち、オンラインプラットフォーム、電子メールなどのインターネット経由申請が720件で77.9%を占め、手紙での申請が189件で20.5%を占め、ファックスでの申請が2件で0.2%を占め、書類手渡しでの申請が13件で1.4%を占めた。

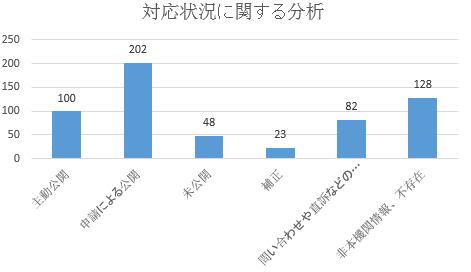
(二)対応状況。924件の申請によって公開された事項のうち、電話での対応が51件、申請者による申請撤回が52件、対応中が8件(いずれも企業の意見を募集中)だった。残りの813件はいずれも法定期間内に対応済みで、書面の回答で対応したは583件(申請者が同一である申請事項の一部に対しては、合併して回答した)だった。583件の回答のうち、主動公開のものが100件で17.2%を占め、申請によって公開したものが202件で34.6%を占め、「企業秘密」などで未公開のものが48件で8.2%を占め、申請者に補正を通告したものが23件で3.9%を占め、問い合わせや直訴などのルートで別途対応になったものが82件で14.1%を占め、「本部門に関する情報ではない」「情報が存在しない」などその他状況が128件で22.0%を占めた。

四、情報公開関係費用徴収の状況
2018年、国家医薬品監管局は申請による情報公開業務で、申請者に費用をいっさい徴収しなかった。
五、行政不服審査と行政訴訟の状況
2018年、国家医薬品監管総局は政府情報公開で申請された行政不服審査が8件、初審に入った行政訴訟が9件だった。8件の行政不服審査のうち、申請者による自主撤回が2件、不受理と決定されたのが2件、国家医薬品監督総局の行政行為を維持するという審査結果になったのが4件だった。9件の行政訴訟のうち、訴訟不受理になったのが6件、裁判所が原告の訴訟撤回申請を許可したのが2件、裁判所が原告の請求を拒絶したのが1件だった。
六、主な問題と改善措置
政府情報公開の推進における主な問題と困難は自主公開した情報は内容面で深みと幅が物足りないため、改善する余地があり、情報効果のメカニズムと業務水準も向上する必要があることである。2019年、国家医薬品監管局は党の十九大の精神を徹底的に発揚し、「中華人民共和国政府情報公開条例」と国務院の関係規定に従い、全システムの監管情報公開に力を入れ、プラットフォームの建設をより強化し、業務実施能力をより高め、以下の業務を重点業務とする予定である。
(一)情報自主公開に注力すること。
(二)情報公開プラットフォームの建設を強化すること。
(三)幹部チームの育成と能力向上を促進すること。
(出所:国家医薬品監督管理局サイト2019-03-29)



 ホーム
ホーム 最新情報
最新情報 機構紹介
機構紹介 国際交流
国際交流 サイトについて
サイトについて