国家医薬品副作用モニタリングセンターは、2018年中国における医薬品副作用モニタリング情況を全面的に把握し、医薬品安全使用レベルを高め、国民の医薬品安全使用をさらに保障するために、「国家医薬品副作用モニタリング年間報告書(2019年)」を作成し、2020年4月10日より発布した。
一、医薬品副作用モニタリング実施情況
2019年、習近平総書記が食品と医薬品安全に関して提唱した「四つの『最厳格』」要求に基づき、医薬品副作用モニタリングが順調に展開され、関係法規と制度が引き続き改善させ、モニタリングシステムが次第に整備し、報告件数とクオリティが穏やかに上昇し、リスク制御手段がより成熟し、関係業務が顕著な成果と効果をあげ、医薬品監督管理を力強くサポートした。
第一に、情報システムを整備し、モニタリングと評価業務の基礎をより固めた。国家医薬品副作用モニタリングネットワークを整備させ、医薬品上市許可保有者(以下、「保有者」と略称。)が医薬品副作用を直接報告するモニタリングシステムが本格的に稼働し、保有者による副作用モニタリングを効果的に推進した。医療機構との協力を引き続き強化し、医薬品副作用モニタリングの新しいモデルを模索し、189カ所の三級医療機構で医薬品副作用モニタリング拠点を設置した。2019年、全国では、97.4%の県レベル地域が医薬品副作用/事件を報告し、人口百万人当たりの平均報告件数が1,130件に達し、深いレベルまでモニタリングと評価業務を展開するために堅実な基礎を築いた。
第二に、科学的評価に注力し、リスクの兆しに速やかに対処した。健全な日間モニタリング、週間総括、四半期ごと分析メカニズムを構築すると同時に、国内外の監督管理動向に注目し、医薬品臨床使用の実状と緊密に結び付け、医薬品副作用報告データに対する分析と評価に持続的に注力した。評価の結果に基づき、医薬品安全性に関する警告情報を適時に公開した。また、フラゾリドン含有製剤生産、販売、使用停止の公告を発表し、医薬品添付文書修正公告を27回発表し、「薬物警戒速報」を12号発行した。早期警戒管理プラットフォームの機能を引き続き最適化し、リスクの兆しに対して早期発見、早期対応、早期調査、早期処置を行い、国民の医薬品安全使用を確実に保障した。
第三に、規則の構築を強化し、ICHガイドラインのローカリゼーションと実施を推進した。「市販後医薬品臨床安全性文献評価ガイドライン(試行版)」、「医薬品上市許可保有者向け医薬品安全性情報管理年次報告書作成ガイドライン(試行)」を発布し、保有者がモニタリング、報告、分析および評価を展開するよう指導した。医薬品規制調和国際会議 (ICH)E2B(R3)のローカリゼーションと実施を穏やかに推進し、「個別症例安全性報告を伝送するためのデータ項目(E2B(R3))の実装ガイド」を発布した。国際医薬用語集(MedDRA)の使用を促進し、疾病専門用語の研究を展開し、保有者とモニタリング機構向け研修を強化し、ICHガイドラインを全面的に実施するための技術的保障を提供した。
第四に、積極的に広報活動と指導を行い、国民の副作用認知度を高めるよう努めた。第7回中国医薬品安全性情報管理大会を開催し、医薬品安全性情報管理に関する学術交流と経験共有を促進した。医薬品副作用モニタリングに関する研修を実施し、保有者が安全主体責任を果たすよう指導し、リスク管理意識を強化した。全国医薬品安全使用月間プラットフォームを十分に利用し、インターネット、テレビ、新聞等のメディアも活用して医薬品副作用に関する知識を積極的に宣伝し、一般開放日および都市と農村共同建設等の多様な活動を展開し、国民の医薬品副作用認知度向上に努めた。
二、医薬品副作用/事件の報告情況
(一)報告の全体情況
1、2019年医薬品副作用/事件報告情況
2019年、全国医薬品副作用モニタリングネットワークは151.4万件の「医薬品副作用/事件報告表」を収集した。1999年から2019年まで、全国医薬品副作用モニタリングネットワークは累計で1519万件の「医薬品副作用/事件報告表」を収集した(図1)。


図1 1999-2019年全国医薬品副作用/事件報告件数の増加情況
2、新規および重篤医薬品副作用/事件の報告情況
2019年、全国医薬品副作用モニタリングネットワークは47万7000件の新規および重篤医薬品副作用/事件報告を収集した。新規および重篤医薬品副作用/事件報告は同時期報告総数の31.5%を占めた。
2019年、全国医薬品副作用モニタリングネットワークは15万6000件の重篤医薬品副作用/事件報告を収集し、重篤医薬品副作用/事件報告は同時期報告総数の10.3%を占めた(図2)。
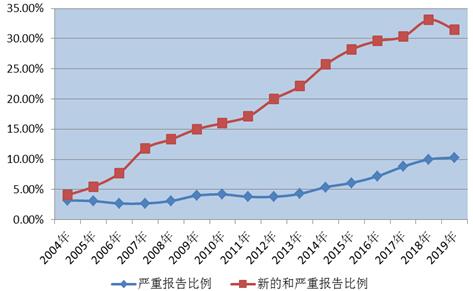

図2、2004-2019年新規と重篤および重篤医薬品副作用/事件報告の割合
3、百万人あたり平均報告の情況
百万人あたりの平均報告件数は一国の医薬品副作用モニタリング水準を判断する重要な指標の一つである。2019年、中国における人口100万人当たりの平均報告件数は1130件だった。
4、医薬品副作用/事件の県レベル報告の比例
医薬品副作用/事件の県レベル報告の比例は全国医薬品副作用モニタリングの均衡的発展およびカバー率を評価する重要な指標の一つである。2019年、中国全国医薬品副作用/事件の県レベル報告の割合は97.4%だった。
5、医薬品副作用/事件報告の出所
医薬品上市許可保有者、経営企業および医療機構は医薬品副作用報告の責任者である。報告出所の統計によると、2019年、医療機構による報告は88.1%、医薬品経営企業による報告は6.6%、医薬品上市許可保有者による報告は5.2%を占めた。また、個人およびその他報告者による報告は0.1%であった(図3)。
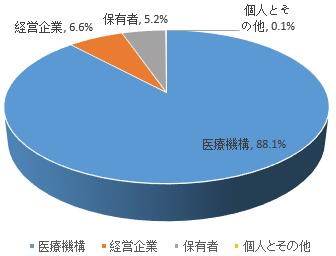

図3 2019年医薬品副作用/事件報告の出所について
6.報告者の職業
報告者職業別では、医師は56.6%、薬剤師は22.3%、看護師は15.3%、その他職業は5.8%となっている(図4)。
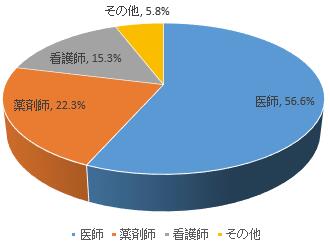

図4報告者の職業について
7、医薬品副作用/事件報告にかかわる患者の情況
2019年医薬品副作用/事件報告のうち、男女患者比は0.86:1で、女性は男性よりやや多かった。14歳以下の小児患者に関する報告は10.2%で、65歳およびそれ以上の高齢者に関する報告は29.1%だった(図5)。
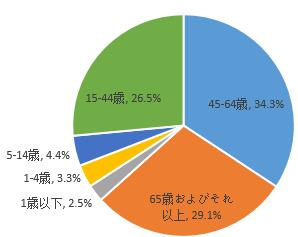

図5医薬品副作用/事件報告にかかわる患者の年齢層について
8、医薬品副作用/事件報告にかかわる医薬品の情況
副作用が疑われる医薬品を類別によって統計すると、化学医薬品は84.9%、漢方薬は12.7%、生物由来製品は1.6%、分類不可能は0.8%だった(図6)。
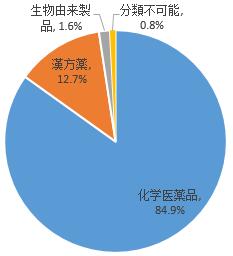

図6 医薬品副作用/事件報告にかかわる医薬品の類別について
医薬品投与ルート別に統計すると、注射投与は62.8%、経口投与は32.5%、その他投与は4.7%だった。注射投与のうち、静脈注射投与は92.5%、その他注射投与は7.5%だった(図7)。


図7 医薬品副作用/事件報告における投与ルートについて
9、器官系損傷をもたらす医薬品副作用/事件の報告情況
2019年に報告された医薬品副作用/事件のうち、損傷ランキングトップ5になったのは皮膚およびその付属器損傷、胃腸損傷、全身的損傷、神経系統損傷、心血管系損傷だった(図8)。
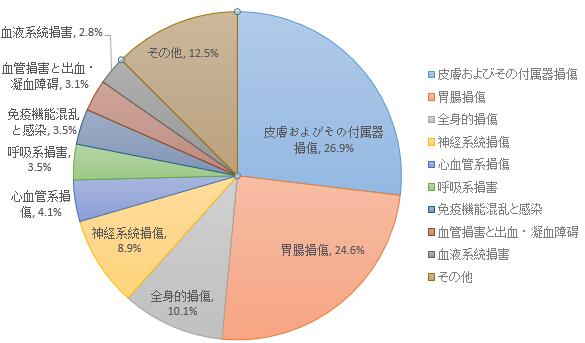

図8 2019年器官系損傷をもたらす医薬品副作用/事件について
(二)必須医薬品モニタリングの情況
1、必須医薬品モニタリングの全体情況
2019年、全国医薬品副作用モニタリングネットワークは「国家必須医薬品目録」(2018版)収録品目の副作用/事件に関する報告を合計で68万件を収集した。そのうち、重篤副作用報告は7万6000件で、11.2%を占めた。また、化学医薬品と生物由来製品関係報告は89.5%、漢方薬関係報告は10.5%を占めた。
2、必須医薬品に属する化学医薬品と生物由来製品報告情況の分析
「国家必須医薬品目録」(2018版)における化学医薬品と生物由来製品の部分は417品目(類)を収録している。2019年、全国医薬品副作用モニタリングネットワークは必須医薬品に属する化学医薬品と生物由来製品の副作用/事件報告を64.8万件を収集し、そのうちの重篤報告は8.8万件で、13.5%を占めた。
2019年国家必須医薬品に属する化学医薬品と生物由来製品の副作用/事件報告を医薬品類別で統計すると、報告件数の上位5位は抗微生物薬、心血管系用医薬品、抗腫瘍薬、ホルモンおよび内分泌に作用する薬、向精神薬だった。器官系損傷をもたらす医薬品副作用のトップ5は皮膚およびその付属器損傷、胃腸損傷、全身損傷、神経系統損傷および心血管系損傷だった。
3、国家必須医薬品に属する漢方製剤副作用報告情況の分析
「国家目必須医薬品録」(2018版)における漢方製剤の部分は268品目を収録している。2019年、全国医薬品副作用モニタリングネットワークは国家必須医薬品に属する漢方製剤の副作用/事件報告を延べ8.9万件を収集し、そのうちの重篤報告は延べ6692件で、7.6%を占めた。2019年、国家必須医薬品に属する7種類漢方製剤のうち、副作用/事件報告件数の多い順で並べると、内科用医薬品、整形外科用医薬品、婦人科用医薬品、外科用医薬品、耳鼻咽喉科用医薬品、小児科用医薬品、眼科用医薬品となる。
以上のモニタリングデータで示さているように、2019年、国家必須医薬品モニタリングの全体情況は基本的に安定していた。
(三)化学医薬品、生物由来製品モニタリング情況
1.全体情況
2019年、医薬品副作用/事件報告のうち、副作用が疑われる医薬品に関する報告は延べ163万5000件だった。そのうち、化学医薬品は84.9%を占め、生物由来製品は1.6%を占めた。また、重篤副作用/事件報告のうち、副作用が疑われる医薬品は延べ19万9000件だった。そのうち、化学医薬品関係は90.0%を占め、生物由来製品関係は1.9%を占めた。
2、患者の情況
2019年、化学医薬品、生物由来製品の副作用/事件報告では、男女患者比は0.86:1で、女性は男性よりやや多かった。14歳以下の小児患者に関する報告は10.6%で、65歳以上の高齢患者に関する報告は29.0%だった。
3、医薬品の情況
2019年、医薬品副作用/事件報告にかかわる化学医薬品のうち、症例件数の上位5位を占めたのは抗感染薬、心血管系用医薬品、腫瘍治療用医薬品、鎮痛剤、電解質、酸塩基平衡調節用医薬品および栄養剤である。2019年、化学医薬品関係重篤副作用/事件報告のうち、報告件数は最も多かったのは抗感染薬で、全体の32.2%を占めた。その次は腫瘍治療用医薬品で、28.8%を占めた。化学医薬品関係重篤報告を品目でみれば、腫瘍治療用医薬品関係重篤報告の割合は42.1%と最も高く、その次は免疫系統用医薬品の24.3%である。
2019年、副作用/事件報告にかかわる生物由来製品のうち、抗毒素および免疫血清は32.3%、サイトカインは24.2%、血液製品は4.7%を占めた。
剤型別で統計すると、化学医薬品副作用/事件報告のうち、注射剤関係と経口製剤関係はそれぞれ66.2%と29.8%、その他剤型関係は4.0%を占めた。生物由来製品副作用/事件報告のうち、注射剤関係は97.5%、経口製剤関係は0.3%、その他は2.2%だった。
4、全体情況の分析
2019年、化学医薬品と生物由来製品副作用/事件の報告情況は基本的に2018年と変わらなかった。医薬品の類別でみれば、抗感染薬の報告件数が引き続きトップを占めたものの、報告総件数に占める割合が毎年低下傾向を呈している。しかし、抗感染薬の使用リスクが依然として注目すべきだと示された。腫瘍治療用医薬品は重篤報告の割合が増加傾向にあり、重篤報告の1位まで上昇しており、その使用リスクに注目しなければならない。患者の年齢層を見ると、65歳およびそれ以上の高齢患者に関する副作用報告の割合が2018年と比べてやや上昇し、高齢者の医薬品安全使用にに注目しなければならないと示された。
(四)漢方薬モニタリング情況
1、全体情況
2019年、医薬品副作用/事件報告のうち、副作用が疑われる報告は延べ163万5000件で、そのうちで漢方薬関係は12.7%を占めた。重篤副作用/事件報告のうち、副作用が疑われる報告は19万9000件で、そのうちで漢方薬関係は7.1%を占めた。
2、患者情況
2019年、漢方薬副作用/事件報告のうち、男女患者比は0.82:1で、女性は男性より多かった。また、14歳以下児童患者に関する報告は8.1%を占め、65歳以上高齢患者に関する報告は28.2%を占めた。
3、医薬品情況
2019年、医薬品副作用/事件報告にかかわる漢方薬のうち、報告件数の上位5位を占めた品目は理血剤に属する血行促進薬(28.4%)、清熱剤に属する清熱解毒薬(11.4%)、保養剤に属する益気養陰薬(6.8%)、開心剤に属する涼開薬(6.1%)、祛湿剤に属する清熱除湿薬(5.7%)だった。漢方薬重篤副作用/事件報告のうち、報告件数の上位5位を占めた品目は理血剤に属する血行促進薬(39.8%)、保養剤に属する益気養陰薬(13.0%)、開心剤に属する涼開薬(10.5%)、清熱剤に属する清熱解毒薬(8.6%)、解表剤に属する辛涼解表薬(3.8%)だった。
2019年、漢方薬副作用/事件報告を投与ルートでみると、静注投与関係は45.5%、経口投与関係は46.4%、その他投与関係は8.1%を占めた。注射投与のうち、静脈注射は98.5%、その他注射は1.5%だった。
4.全体情況の分析
2019年、漢方薬副作用/事件報告の総件数と重篤報告件数はいずれも2018年と比べてある程度減った。投与ルートでみると、注射投与の割合がやや下がった。品目別でみると、血行促進薬関係報告は件数が依然としてトップを占めたものの、割合がやや下がった。全体からみれば、2019年、各品目漢方薬の副作用/事件報告が減少傾向だったが、漢方薬を安全に使用するよう依然として注意しなければならない。
三、関係リスクの制御措置
2019年の医薬品副作用モニタリングデータと分析結果に基づき、国家医薬品監督管理局は潜在的安全上リスクが発覚された医薬品に対して、国民の医薬品安全使用を保障するために、速やかにリスク制御措置をとった。
(一)フラゾリドン製剤の生産、販売を停止すると公告で発表した。
(二)セフォペラゾン含有製剤、丹参リグストラジン注射液、ヒキガエル分泌液注射液等の添付文書の修正公告27期を発表し、添付文書における警告語、副作用、注意事項、禁忌症などの安全性関係情報を68品目(類)追加、もしくは修正した。
(三)「薬物警戒速報」12期を発表し、68品目海外医薬品の安全情報を公開した。
四、各論(省略)
五、関係説明
(一)本年次報告書のデータは、国家医薬品副作用モニタリングデータベースに収録され、2019年1月1日から2019年12月31日までの間に各地域で報告されたデータに由来するものである。
(二)多くの国々と同様に、中国の医薬品副作用報告も自発報告システムで収集してデータベースに登録したものである。しかし、自発報告システムには限界が存在している。限界とは、例えば、報告漏れ、記入基準不適合、情報不完全、副作用発生率計算不可能などである。
(三)各種医薬品副作用/事件報告の件数は当該医薬品の使用量と副作用発生率等の諸要素に影響される。それゆえ、副作用/事件報告の件数は医薬品副作用発生の度合いまたは重篤度を直接代表しない。
(四)本年次報告書を完成した時点では、一部の重篤報告、死亡報告がまだ調査中で、すべての集計結果が現段階における実際の情況を示したもので、最終的な調査と評価の結果ではない。
(五)専門家は、医薬品と副作用/事件象の関連性を分析し、医薬品安全性リスク情報をまとめ、関係リスクの普遍性または重篤さに基づき、関係措置をとるかどうかを決定する。具体的には、医薬品添付文書に安全性情報を記入するかどうか、いかに医薬品安全使用情報を更新するかなどである。極まれに医薬品のベネフィットがリスクより大きくなくなったと判断された場合、医薬品は市場から撤回も命じられる。
(六)本年次報告書におけるデータは、いずれも全国医薬品副作用モニタリングネットワークより収集したものである。ワクチン副作用/事件のモニタリンデータを含まない。
(出所:医薬品副作用モニタリングセンターサイト 2020-04-10)



 ホーム
ホーム 最新情報
最新情報 機構紹介
機構紹介 国際交流
国際交流 サイトについて
サイトについて