結論
2021年には、医薬品臨床試験登録および情報公開プラットフォームの年間登録総数が初めて3,000件を超え、合計3,358件になった。新薬臨床試験数の割合は逐年増加し、第I相臨床試験が長年にわたって最も高い割合を占め、そのほとんどは国内の依頼者によって開始された国内の試験であった。BE試験数の割合は、過去3年間で徐々に減少傾向を示している。
過去3年間、化学薬品と生物学的製剤の臨床試験は依然として主に腫瘍の適応を目的としている。薬物作用ターゲットは比較的集中しており、そのうち、PD-1とPD-L1が特に顕著であり、それらに関する第III相臨床試験の数も比較的多い。新型コロナウイルス感染症の流行の影響を受けて、2021年に、予防ワクチン類の生物学的製剤は、新型コロナウイルス不活化ワクチンの臨床試験数が最も多くなっている。漢方薬の臨床試験数は、ここ数年間で最も少なく、主に呼吸、消化、心血管および精神神経の4つの適応症に焦点を当てる。
高齢者と小児(予防ワクチンを除く)を対象とする臨床試験の割合はまだ比較的低く、希少疾病用医薬品の臨床試験に関与する疾患の種類はまだ比較的少ない。2021年の登録情報では、6か月以内に被験者の募集を開始する割合が大幅に増加している(51.4%)。
要約すると、中国における新薬臨床試験の数は増加し続け、その上ほとんどが国内依頼者によって開始および実施された新薬臨床試験である。新薬第III相臨床試験の数が継続的に増加するにつれ、中国での新薬販売申請の数が増加し、小児集団や希少疾病用医薬品の臨床投薬ニーズを含む中国人患者の新薬治療のニーズを満たすためにプロセスが加速されることが期待される。
第一章 医薬品臨床試験登録の全体概要
2021年に、中国における医薬品臨床試験登録数が初めて3,000件を超え、合計3,358件の臨床試験が登録され、2020年と2021年の年間登録総数は前年度と比較してそれぞれ9.1%と29.1%増加した。
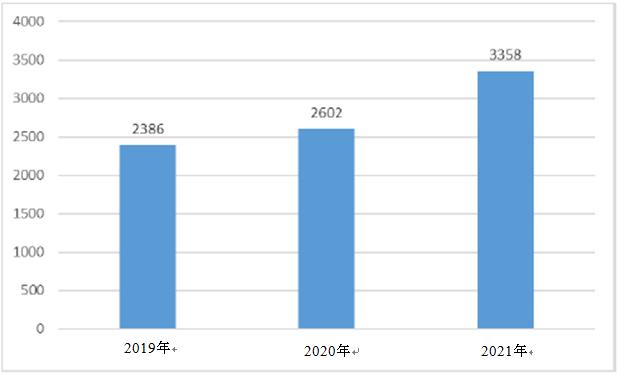
2019~2021年の臨床試験登録総数の変化(CTRとして)
漢方薬、化学薬品、および生物学的製剤の種類別の統計によると、2021年に、中国医薬品臨床試験で最も大きな割合を占めたのは、依然として化学薬品の70.8%であり、次に生物学的製剤の26.7%であった。最も少なかったものは漢方薬であり、わずか2.4%であった。過去3年間のデータを比較すると、各種医薬品の臨床試験数の割合は類似しているが、生物学的製剤の割合は逐年増加し、化学薬品や漢方薬の割合は逐年減少の傾向を示した。
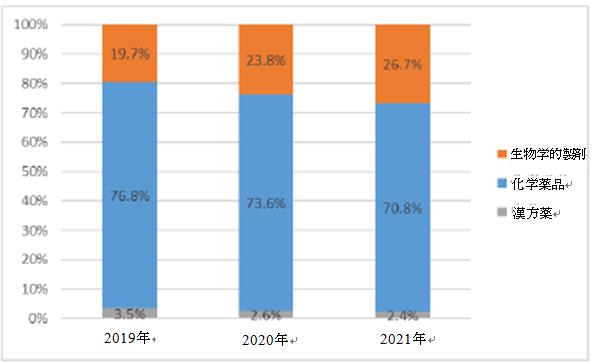
各種類の医薬品の全体的な割合の変化(2019-2021)
第二章 臨床試験の基本的な特性情報の分析
一、依頼者の種類
受入番号の種類に応じて、依頼者の種類を分析する。つまり、受入番号がJで始まるものは外国の依頼者としてカウントされ、その他は国内の依頼者としてカウントされる。2021年に登録された臨床試験のうち、依然として依頼者は主に国内企業であり、78.9%(1,678件)を占めた。過去3年間、依頼者の種類の割合にほとんど変化はなく、外国企業が占める割合は30%未満であり、2019年は最も低い19.1%であった。
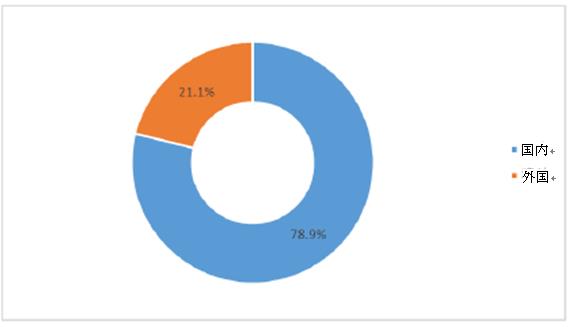
2021年臨床試験依頼者の種類の分布
二、臨床試験の種類の分析
新薬臨床試験(受入番号で登録)と生物学的同等性試験(BE試験、主に届出番号で登録)に従って統計すれば、2021年には2,033件の新薬臨床試験(60.5%)が登録され、1,325件のBE試験(39.5%、受入番号で登録された94件のBE試験を含む)が登録された。過去3年間のデータを比較すると、新薬の臨床試験数の割合は逐年増加したが、BE試験数の割合は逐年減少の傾向を示している。
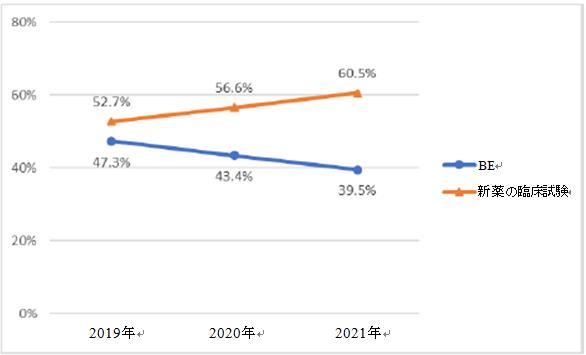
新薬臨床試験の割合の変化(2019-2021)
過去3年間の新薬臨床試験の登録データを比較すると、各種医薬品の割合は長年にわたって一貫しており、化学薬品の数が最も多く(年間54.6%)、次に生物学的製剤(年間40.4%)と漢方薬が続いている。2021年に受入番号で登録された新薬臨床試験のうち、化学薬品、生物学的製剤、漢方薬について、それぞれ1,069件(52.6%)、886件(43.6%)、78件(3.8%)が登録された。各種医薬品の割合の観点から、生物学的製剤の試験件数は大幅に増加し、2020年と2021年の登録数は前年比でそれぞれ31.5%と46.4%増加し、2019年と2020年の登録数はそれぞれ460件と605件であった。
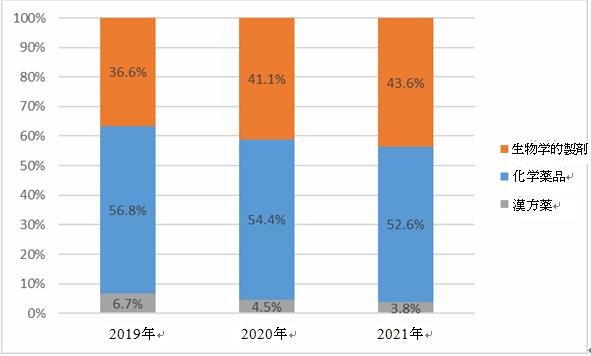
各種類の医薬品における新薬臨床試験の割合の変化(2019-2021)
三、医薬品の種類及び作用ターゲットの分析
1、新薬臨床試験の品目
各種類の医薬品に応じて、2021年に2,033件の新薬臨床試験に関与した品目の数(臨床試験承認文書の医薬品名による)を統計し、過去3年間のデータを分析した。
漢方薬:2021年には、漢方薬の品目の約90%に対して1つの臨床試験のみが実施され、芪參益気滴丸(Qishen Yiqi Dropping Pills)、蘇孜阿甫錠(Suzi Afu Tablets)、保婦康栓(Baofukang suppository)、人工熊胆パウダー(Artificial Bear Bile Powder)などの品目に対して2つの臨床試験が実施された。その中で、蘇孜阿甫錠は1回の一時中断試験を含み、プロトコルが更新された後に臨床試験を再開した。過去3年間のデータの全体的な傾向は基本的に同じであり、品目のほぼ90%が同じ年に1つの試験しか行っていない。
化学薬品:2021年に化学薬品の上位10品目の臨床試験に合計68件の試験が登録され、ミトキサントロン塩酸塩リポソーム注射液は9件の試験で最大の試験数になる。2020年と比較すると、同じ点は、上位10品目すべてに抗腫瘍薬のミトキサントロン塩酸塩リポソーム注射液、リンゴ酸ファミチニブカプセル、塩酸ジャクチニブ錠、フルゾパリブカプセルが含まれていることであり、異なる点は、上位10品目に4つの非抗腫瘍薬(それぞれ、塩酸ヨンケナフィル錠、SHR0302錠、DBPR108錠及びYZJ-1139)が含まれていることである。過去3年間のデータ分析によると、各年上位10品目の50%以上が抗腫瘍薬であり、フルゾパリブカプセルは過去3年間連続して上位10品目の1つである。
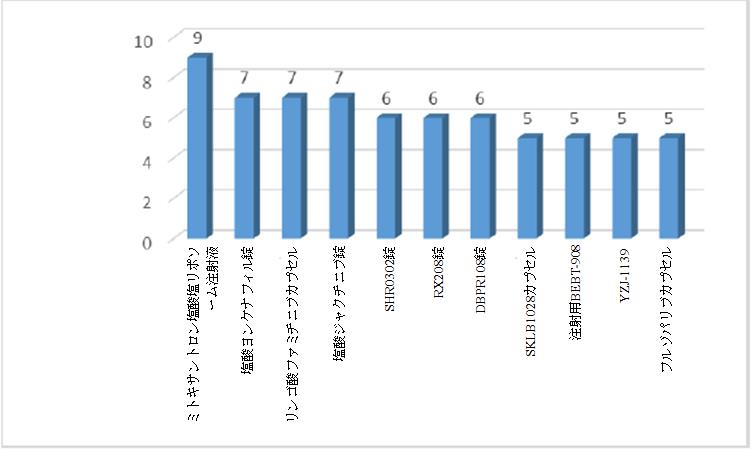
2021年化学薬品の臨床試験数の上位10品目
生物学的製剤:2021年には、生物学的製剤における臨床試験数の上位10品目に、主に治療用生物学的製剤を対象とした合計104件の試験が登録され、10品目の合計75件の試験(72.1%)が含まれ、予防用の生物学的製剤が2品目の29件の試験(27.9%)に関与し、そのすべてが新型コロナウイルスワクチンである。単一品目の臨床試験数の分析から、新型コロナウイルス不活化ワクチン(Vero細胞)の臨床試験数が最も多く、20件であり、続いて、チスレリズマブ注射液とアテゾリズマブ注射液、両方とも10件、どちらも2020年の上位10品目である。過去3年間のデータを比較すると、上位10品目は主に治療用の生物学的製剤であり、そのうち、2019年の88.7%が最も高い割合であった(94 vs. 106)。ペムブロリズマブ注射液は、過去3年間連続して上位10品目の1つである。

2021年生物学的製剤の臨床試験数の上位10品目
2、新薬臨床試験品目の作用ターゲット
医薬品品目の統計によると、2021年に登録された臨床試験の上位10位のターゲットは、PD-1、PD-L1、VEGFR、HER2などであり、品目の数は71、59、46及び43(「受入番号」で計数され、繰り返されることはない)と高い。そのうち5つのターゲット(PD-1、PD-L1、HER2、EGFR、CD3)の薬物適応症の90%以上が抗腫瘍分野に集中し、4つのターゲット(PD-1、PD-L1、HER2、EGFR)の薬物適応症はすべて抗腫瘍分野に集中している。
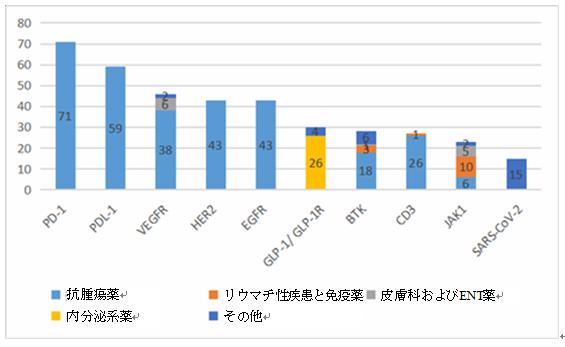
2021年上位10位のターゲットの品目数と適応症の分布
臨床試験の数によると、2021年に臨床試験の数が最も多い上位10位のターゲットは、PD-1、PD-L1、HER2、EGFRなどであり、それぞれ84件、68件、57件、53件となっており、中でもPD-1およびPD-L1ターゲットの第III相臨床試験がそれぞれ36件及び21件と高い。また、4つのターゲット(VEGFR、GLP-1/GLP-1R、JAK1、CD3)の薬物臨床試験における第I相臨床試験の割合は40%を超え、各ターゲットにおける第II相臨床試験の割合は8%~37%の範囲内である。
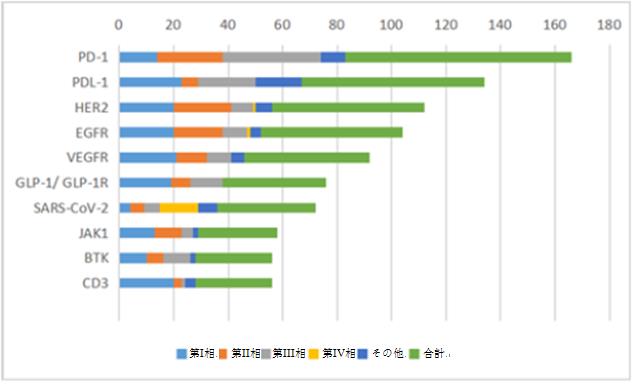
2021年上位10位のターゲットの臨床試験の数と試験段階
過去3年間のデータ分析と比較すると、医薬品の品目に基づくものであれ、臨床試験登録の数に基づくものであれ、薬物作用ターゲットは依然として比較的集中している。その中でPD-1とPD-L1が特に顕著であり、適応症も主に抗腫瘍分野に集中している。試験段階の分析から、PD-1およびPD-L1ターゲットの第III相臨床試験の割合も他のターゲットよりも高く、他のターゲットは依然として第I相臨床試験を中心とする。
3、生物学的同等性試験の品目
2021年のBE試験(受入番号による登録を含む)の数の上位10品目に関する情報のうち、オセルタミビルリン酸塩ドライ懸濁液の登録試験数が18件、最も多かった。詳しくは次のとおりである。
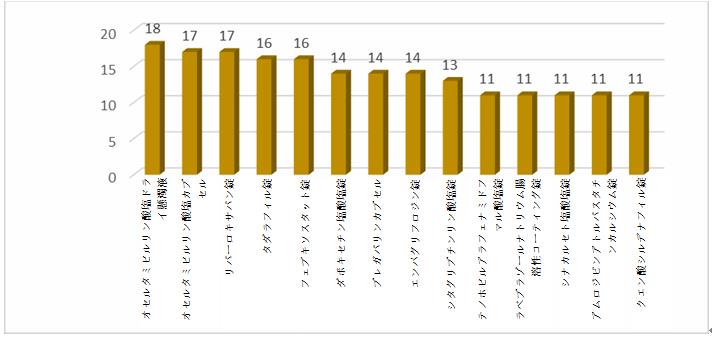
2021年BE試験数の上位10品目
2020年のデータと比較すると、上位10品目に同じ品目が4つあり、それぞれは、オセルタミビルリン酸塩カプセル、リバーロキサバン錠、タダラフィル錠、テノホビルアラフェナミドフマル酸塩錠である。過去3年間のデータ分析から、リバーロキサバン錠はこの数年にわたって上位3品目の1つである。
四、医薬品の種類と登録分類
漢方薬:2021年には、主に元の登録分類第6類(第6類と第6.1類を含む)で合計78件の臨床試験が登録され、50.0%を占め、次に補完申請が続いている。
過去3年間のデータを比較すると、2019年には元の登録分類第6類(第6類と第6.1類を含む)が一番高く、63.1%に達し、2020年には、登録分類第1類(元の登録分類を含む)が主な分類であり、62.5%を占めた。
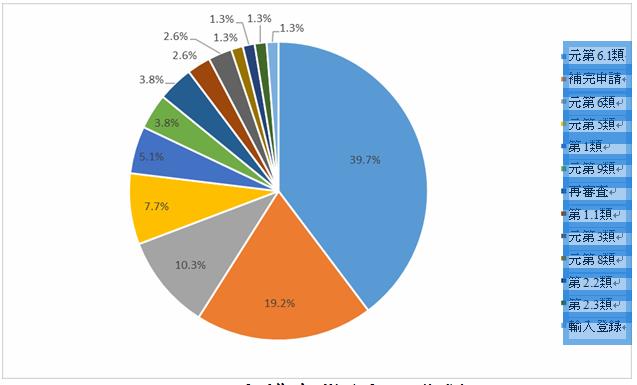
2021年漢方薬登録の分類
化学薬品:受入番号で登録された新薬の臨床試験では、登録分類1(元の登録分類を含む)の医薬品が過去3年間で最大の割合を占め、2020年に最も高い71.2%に達し、2021年と2019年の割合はそれぞれ69.6%と54.2%であった。
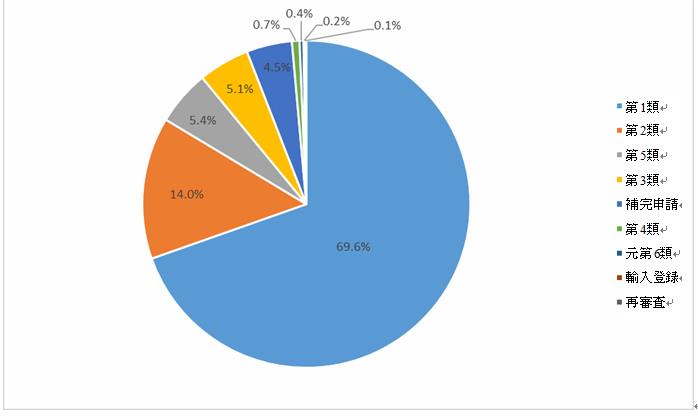
2021年化学薬品登録の分類
生物学的製剤:2021年、治療用の生物学的製剤は主に第1類と第2類(元の登録分類を含む)であり、それぞれ69.7%と12.5%を占めた。予防用の生物学的製剤は主に第1類と元の第6類であり、それぞれ58.3%と9.4%であった。
過去3年間のデータ分析を比較すると、第1類の治療用生物学的製剤の割合は逐年増加の傾向を示し、2019年と2020年にそれぞれ48.7%と65.4%を占めている。第1類の予防用の生物学的製剤の割合についても逐年増加の傾向を示しており、2019年と2020年の割合はそれぞれ31.3%と46%であった。
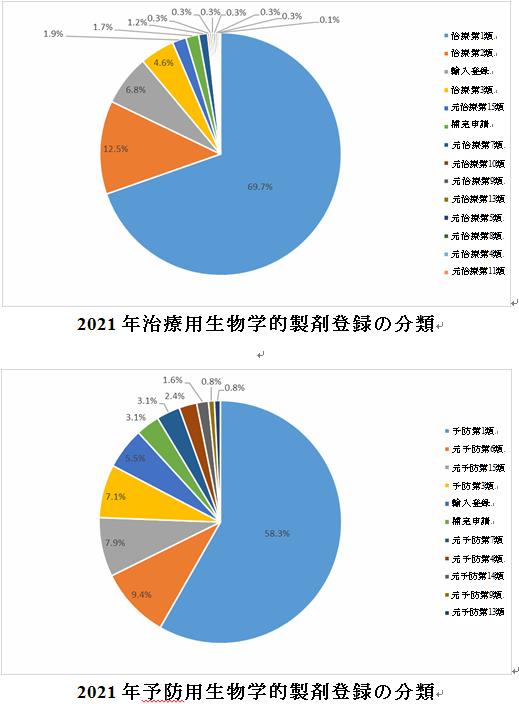
五、対象となる適応症
漢方薬:2021年、漢方薬の新薬臨床試験は、主に精神神経、消化、呼吸、心血管および婦人科の5つの適応症に焦点を当て、漢方薬の全臨床試験の約76.9%を占めた。その中で、精神神経の適応症が最大の割合である19.2%を占めている。また、消化および呼吸の適応症は両方とも16.7%であった。
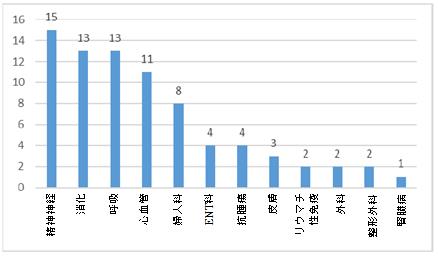
2021年漢方薬に関する臨床試験の適応症の分布
過去3年間のデータを比較すると、主に呼吸、消化、心血管、精神神経の4つの適応症に集中し、それらの全体の割合は60%を超えた(2019-2021年にはそれぞれ61.9%、68.6%および66.7%)が、2021年の呼吸に関する適応症の試験数の割合は2019年および2020年と比較して大幅に低下し、2019年の26.2%から16.7%になった。一方、消化および精神神経に関する適応症の試験数の割合は、2019年と比較して大幅に増加した。さらに、婦人科および抗腫瘍適応症の試験数の割合も、2019年と比較して大幅に増加した。
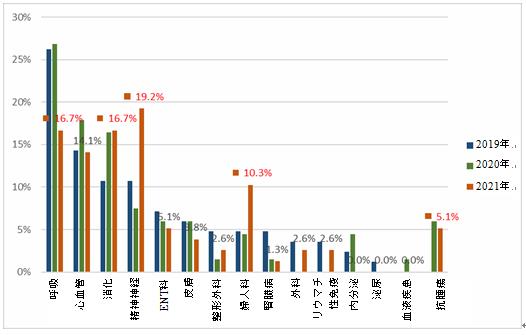
漢方薬に関する臨床試験の適応症の分布変化(2019-2021)
化学薬品:2021年、化学薬品の主な適応症は抗腫瘍薬であり、化学薬品の全臨床試験の39.5%を占め、次に抗感染症薬(7.4%)、皮膚科およびENT薬(6.3%)、鎮痛薬および麻酔薬(6.3%)、循環器系疾患薬(6.2%)および内分泌系薬(5.4%)が続いている。
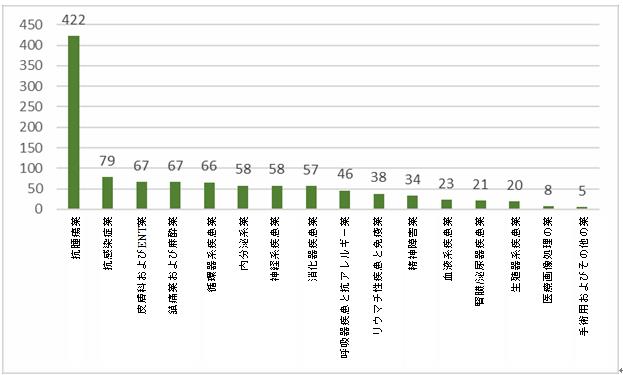
2021年化学薬品に関する臨床試験の適応症の分布
過去3年間のデータを比較すると、主に抗腫瘍薬が30.1%~42.1%を占めている。臨床試験数は逐年増加し、2021年の抗腫瘍臨床試験の数は2019年の約2倍となった(422 vs. 219)。抗感染症薬は、この数年間一貫してそれに次ぐ適応症であり、7.4%~10.1%を占める。循環器系疾患薬と内分泌系薬の割合は、どちらも上位5位の適応症に含まれている。さらに、2021年には、皮膚科およびENT薬、鎮痛薬および麻酔薬、呼吸器疾患と抗アレルギー薬の臨床試験の数が大幅に増加し、2020年の約1.7~2.5倍になる。神経系疾患薬および生殖器系疾患薬の臨床試験の数は、2020年と2021年に、それぞれ2019年の1.3~1.4倍と2.4~2.8倍に大幅に増加した。
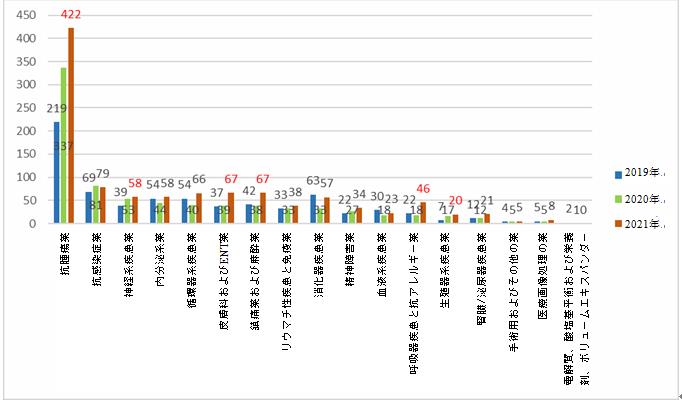
化学薬品に関する臨床試験の適応症の分布変化(2019-2021)
生物制品:2021年の生物学的製剤の適応症も主に抗腫瘍薬であり、生物学的製剤の全臨床試験の45.8%を占め、次に予防ワクチン(14.8%)、皮膚科およびENT薬(7.3%)、内分泌系薬(6.3%)およびリウマチ性疾患と免疫薬(4.7%)が続いている。
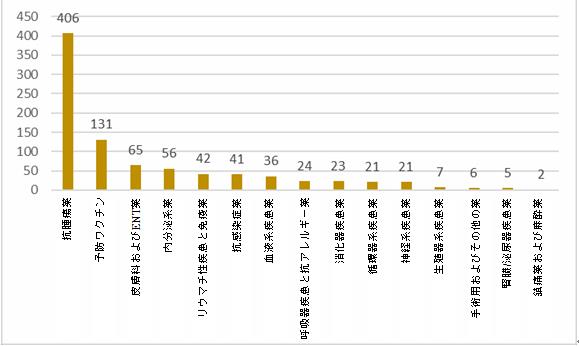
2021年生物学的製剤に関する臨床試験の適応症の分布
過去3年間のデータを比較すると、抗腫瘍薬と予防ワクチンの両方がこの数年間で上位2位の適応症であった。その割合は基本的に一貫した傾向を示しており、それぞれ45.8~48.5%と13.9~14.8%である。皮膚科およびENT薬と内分泌系薬の割合は、この数年間で上位5位の適応症となり、皮膚科およびENT薬に関する臨床試験の割合は、2019年の4.6%から2021年の7.3%へと逐年増加している。一方、内分泌系薬に関する臨床試験の割合は、2019年の8.7%から2021年の6.3%へと逐年減少の傾向を示した。さらに、呼吸器疾患と抗アレルギー薬に関する臨床試験数の割合は、2019年の1.7%から2021年の2.7%へと逐年増加の傾向を示した。抗感染症薬に関する臨床試験数の割合は、2020年の7.3%から2021年の4.6%へと減少した。
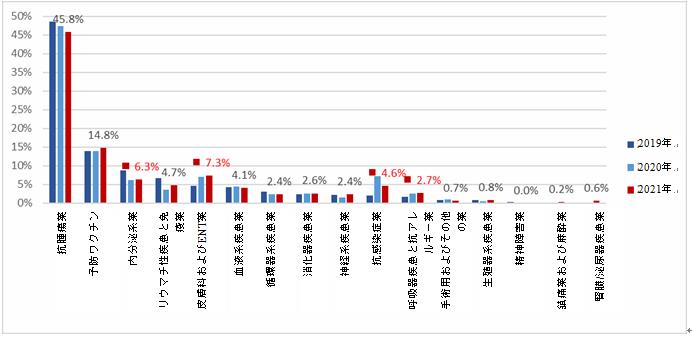
生物学的製剤に関する臨床試験の適応症の分布変化(2019-2021)
六、臨床試験の国内および海外での分布
全体として、依然として医薬品の臨床試験は主に国内の臨床試験である。2021年は国内の医薬品臨床試験が89.8%(3,014件)を占め、国際多施設共同試験が9.7%(325件)を占めた。中国で被験者を募集しない、または海外でのみ実施される単一施設の臨床試験の場合、統計は「その他」に分類され、その割合は0.6%(19件)であった。2021年に受入番号で登録された新薬臨床試験のうち、新薬の国際多施設共同試験が15.8%(321件)と比較的高い割合を占め、国内試験が84.0%(1,708件)を占めた。
過去3年間のデータを比較すると、全体として、医薬品の臨床試験は主に国内の臨床試験である。国際多施設共同試験の割合は逐年増加の傾向を示し、2020年と2021年の登録数は前年比でそれぞれ21.6%と54.3%増加し、2019年と2020年はそれぞれ171件と208件であった。
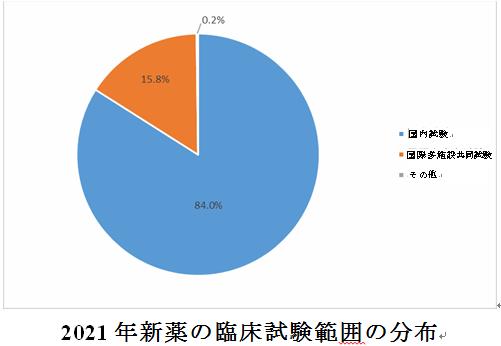
七、臨床試験の段階
2021年に受入番号で登録された新薬臨床試験のうち、第I相の割合が42.9%(872件)、第Ⅲ相及び第Ⅱ相の割合がそれぞれ23.3%(474件)、20.2%(410件)であり、第Ⅳ相の臨床試験が68件(主に販売承認で明確的に必要とされる臨床試験)であった。第I~IV相に完全に分類できないものについては、「その他」に従って統計される(例えば、第Ⅰ/Ⅱ相)。
各相の臨床試験の割合は過去3年間で同じ傾向を保持し、即ち、第I相の臨床試験の割合が最も高く、次に第III相と第II相が続き、第IV相の割合が最も低い。
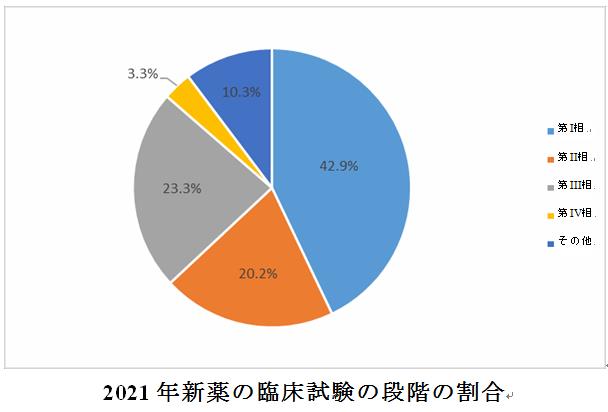
新薬の臨床試験の段階は、医薬品の種類別に分析されている。同じ点は、各段階の臨床試験の割合が過去3年間で同じ傾向を保持し、即ち、化学薬品と生物学的製剤は、依然として第Ⅰ相の割合が比較的高く、漢方薬は依然として第II相が比較的高い割合を占める。2021年、化学薬品と生物学的製剤の第I相臨床試験の割合はそれぞれ50.6%と36.6%であり、漢方薬の第II相臨床試験の割合は64.1%であった。第III相臨床試験に移る生物学的製剤の割合(25.1%)は、化学薬品および漢方薬の割合(それぞれ22.3%および18.0%)よりも高かった。2019年や2020年とは異なり、2021年の漢方薬の第III相臨床試験の割合が最も高く、2019年と2020年の割合はわずか9.0%~10.7%であった。
八、臨床試験のサンプルサイズ分布
2021年に受入番号で登録された新薬臨床試験のうち、国内での対象となる被験者数が登録された試験は合計1,929件で、その平均対象となる被験者数は943.5名である。医薬品の種類や試験段階の統計によると、サンプルサイズの分布は次の通りである。
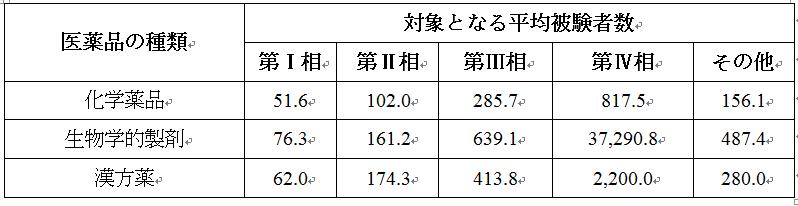
九、臨床試験チームリーダーユニット
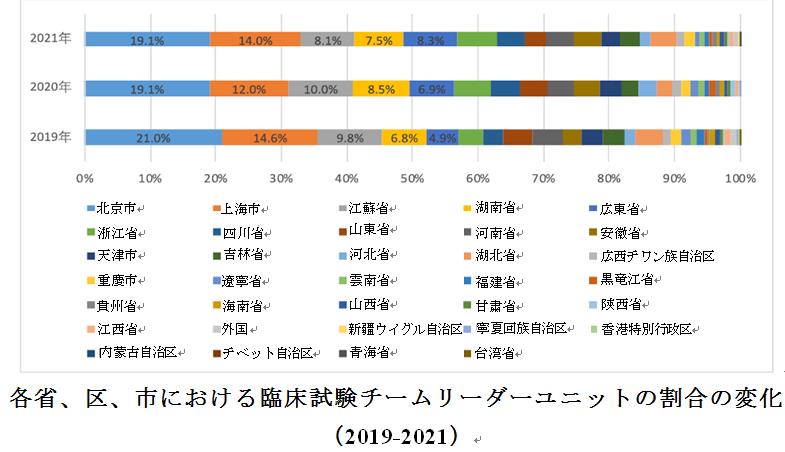
2021年に登録された医薬品臨床試験の中で、北京市臨床試験実施機関はチームリーダーユニットとして最も多くの臨床試験に参加し(1つの臨床試験機関が同時に複数の臨床試験チームリーダーユニットとして機能する場合、参加した臨床試験の回数に応じてカウントされるものとする)、その回数は753回に達し、これは全体の約1/5(19.1%)を示しており、2020年と一致している。
過去3年間に登録されたすべての臨床試験によると、長年にわたってチームリーダーユニットとして最も多くの臨床試験に参加した5つの省、区、市(香港、マカオ、台湾を含む)は、常に北京市、上海市、広東省、江蘇省、湖南省であり、合計で、2019年から2021年までの臨床試験登録総数の57.0%、56.4%、56.9%を占めている。そのうち北京市と上海市は双方とも年間で上位2位に位置しており、2019年から2021年までの臨床試験登録総数のそれぞれ35.6%、31.1%、33.1%を占めた。
十、臨床試験の参加ユニット
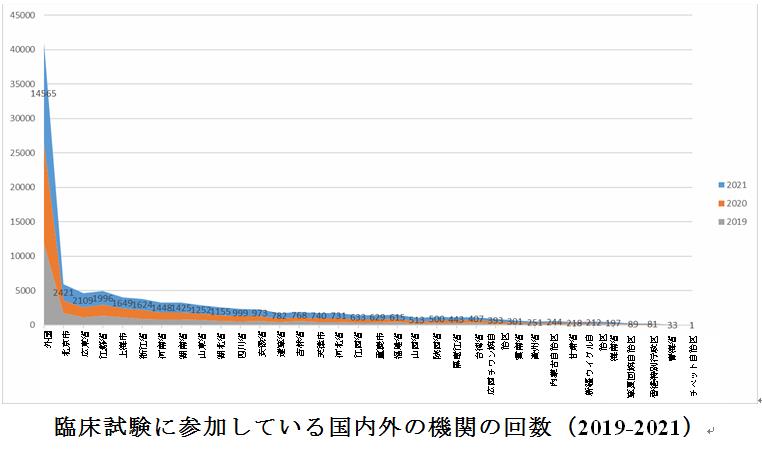
2021年に登録されたすべての医薬品臨床試験には、国内外で合計40,397回の臨床試験ユニット(1つの臨床試験機関が同時に複数の臨床試験の参加ユニットとして機能する場合、参加した臨床試験の回数に応じてカウントされるものとする)が含まれ、中でも、中国(香港、マカオ、台湾を含む)の参加ユニットからの回数が合計25,832回であった。2021年には、北京市、広東省、江蘇省、上海市、浙江省を含む5つの省、区、市が1,500回以上の臨床試験に参加し、2020年よりも大幅に多い数字であった。そのうち、北京市と広東省の参加ユニットは2,000回以上参加している。

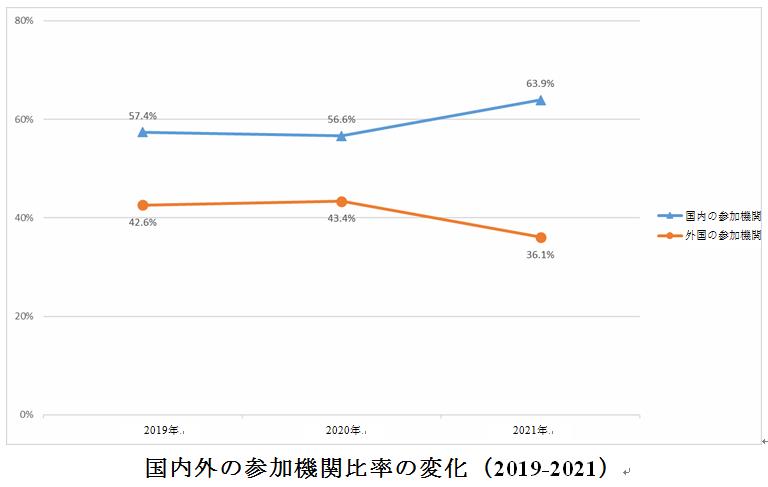
過去3年間のデータを比較すると、中国で2019年と2020年に臨床試験に参加する外国機関の回数の割合は基本的に同じで、それぞれ42.6%と43.4%であったが、2021年には36.1%と一定の減少があった。
第三章 臨床試験のその他の特徴の分析
一、特別な集団における医薬品の臨床試験
1、高齢者集団における医薬品の臨床試験
2021年の医薬品臨床試験では、高齢者を対象とした臨床試験が1,515件あり、受入番号で登録された新薬臨床試験の74.5%を占めた(1,515 vs. 2,033)。高齢者のみを対象に実施された臨床試験は3件あり、0.1%を占めた。具体的な情報は以下の通りである。
過去3年間のデータと比較すると、高齢者集団における試験の数と割合は一貫している。高齢者を対象とした臨床試験は、長年にわたって臨床試験の約70%を占め、高齢者のみを対象に実施された臨床試験は、長年にわたって臨床試験の0.2%に過ぎず、いずれも第III相試験を開始しなかった。
2、小児集団における医薬品の臨床試験
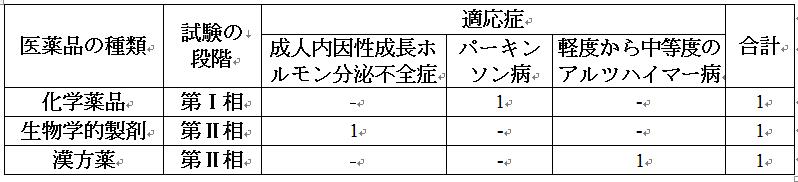
2021年の医薬品臨床試験の中で、小児を対象とした臨床試験が168件あり、受入番号で登録された新薬臨床試験の8.3%(168 vs. 2,033)を占めた。医薬品の種類別に分析すると、生物学的製剤の登録数が最も多く、110件であり、次に化学薬品と漢方薬が続く。適応症の分析によると、化学薬品の主な適応症は抗腫瘍薬、皮膚科およびENT薬である。生物学的製剤の主な適応症は予防ワクチンと血液系疾患薬であり、漢方薬は主に呼吸器薬である。
小児のみを対象に実施された臨床試験が合計61件登録され、新薬の臨床試験の3.0%(61 vs. 2,033)を占めた。医薬品の種類別に分析すると、生物学的製剤は41件で最も多く登録され、化学薬品と漢方薬がそれぞれ16件と4件で続いている。適応症の分析によると、生物学的製剤は主に予防ワクチンであり、生物学的製剤全体の80.5%を占めた。化学薬品は主に皮膚科およびENTの適応症を中心とし、漢方薬は主に呼吸器の適応症を中心とする。
過去3年間のデータと比較すると、小児のみを対象に実施された新薬臨床試験の割合は3%を超えなかった。医薬品の種類と適応症の分析によると、生物学的製剤の予防ワクチン試験が最も多く、漢方薬は主に呼吸器の適応症を中心とし、化学薬品の適応症の分布は比較的散在し、明らかな傾向は認められなかった。
3、希少疾病用医薬品の臨床試験
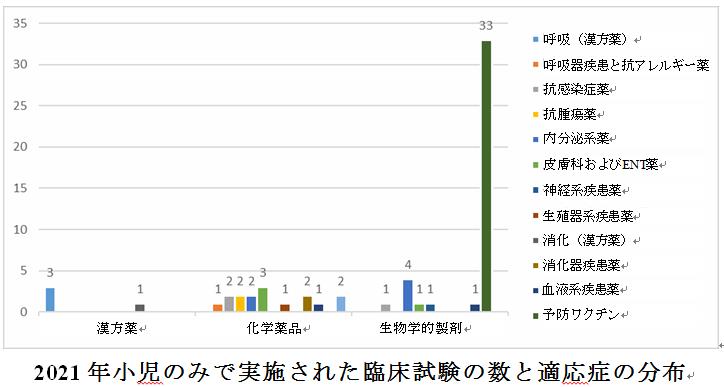
希少疾病の中国語名称をキーワードに、過去3年間の希少疾病用医薬品の臨床試験を分析した。医薬品の種類別に分析すると、希少疾病用医薬品は主に化学薬品と生物学的製剤であり、臨床試験の数は逐年増加の傾向を示し、2021年の臨床試験の総数は2019年の約2倍になった(43 vs. 23)。適応症の分析によると、過去3年間は神経系疾患と血液系疾患が依然として主な疾患であり、2019年と比較して、2020年と2021年の適応症の範囲が徐々に拡大傾向を示している。
二、臨床試験の開始に費やされた時間の分析
受入番号で登録された新薬臨床試験の統計によると、2021年に国内で登録された最初の被験者同意説明文書(ICF)に有効な日付があり、且つ関連する登録番号情報(つまり、2021年以前に承認を受けたが、2021年に新しい試験を追加するなどの例外状況を除く)がない登録は合計819件であった。ICFの署名日と臨床試験の承認日に基づいて臨床試験の開始に費やされた期間を計算し、期間の範囲は3日から91か月で、平均は12.2か月であった。
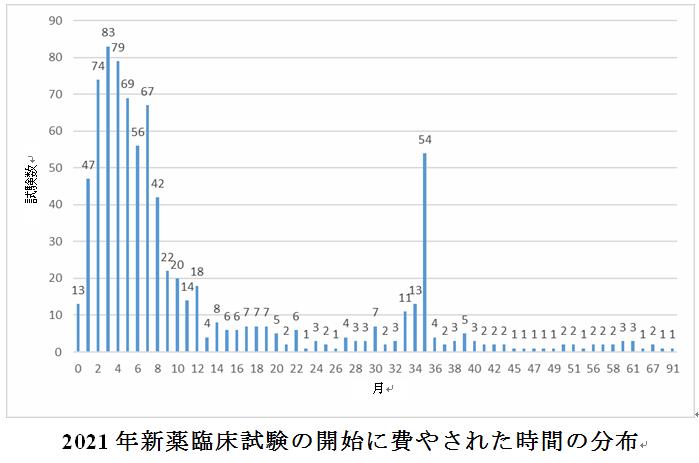
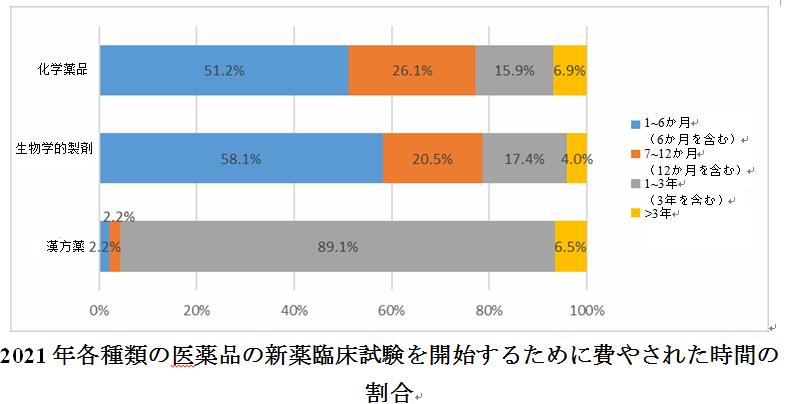
全体として、試験の半数以上(51.4%)が6か月以内に募集を開始することができていた。医薬品の種類の観点から、6か月以内に被験者の募集を開始する化学薬品と生物学的製剤の割合は、漢方薬よりも大幅に高く、それぞれ51.2%と58.1%であった。一方、漢方薬の臨床試験のほぼ90%(89.1%)が1年以上にわたって被験者を募集し始めることが示された。
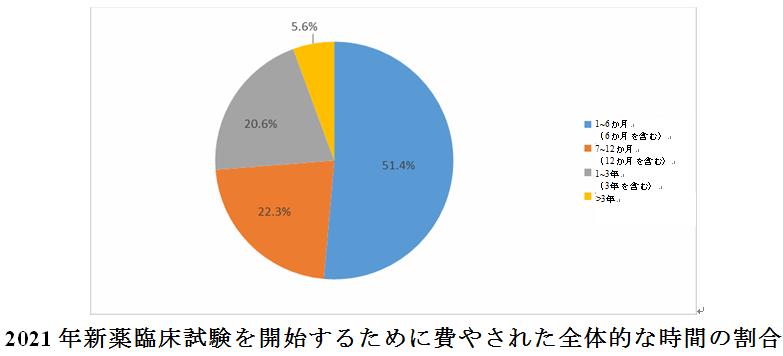
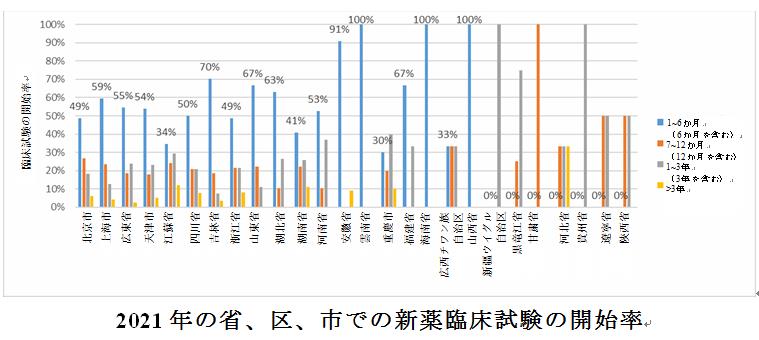
臨床試験実施機関の所在地のさらなる分析と組み合わせると、より多くの臨床試験チームリーダーユニットがある省、区、市は、臨床試験の開始に費やされた時間が比較的長いことがわかる。例えば、2021年の上位5位の省と市は6か月以内に被験者の募集を開始する割合が60%を超えなかった。一方で、安徽、吉林、山東などの省は、臨床試験の開始に費やされた時間が比較的短く、そのうち、雲南省、海南省、山西省は6か月以内に100%の試験開始の実績を達成した。
過去3年間に試験が承認された後の被験者の募集開始状況のみを分析すると(当年度に関連する受入番号が複数ある場合は、最も早い承認日を基準にして計算する)、2021年には合計378件の試験があった。開始期間は3日から11か月で、平均3.8か月で、6か月以内の募集開始率は85.7%に達した。2020年には390件の試験があり、開始期間は0日から14か月で、平均4.7か月で、6か月以内の募集開始率は75.6%であった。2019年には152件の試験があり、開始期間は26日から25か月で、平均6.4か月で、6か月以内の募集開始率は64.5%であった。
三、臨床試験の完了の分析
2021年に受入番号で登録された2,033件の新薬臨床試験のうち、108件が同年に完了(試験状況は「完了」であり、最初の同意説明文書署名日と試験完了日は両方とも2021年以内である)し、それらすべてが国内試験で、主に第I相臨床試験(95件、87.9%)であった。医薬品の種類別に分析すると、化学薬品は5つの第III相臨床試験を含む最も多い91件(83.0%)を完了し、生物学的製剤は1つの第IV相臨床試験を含む15件の試験を完了した。
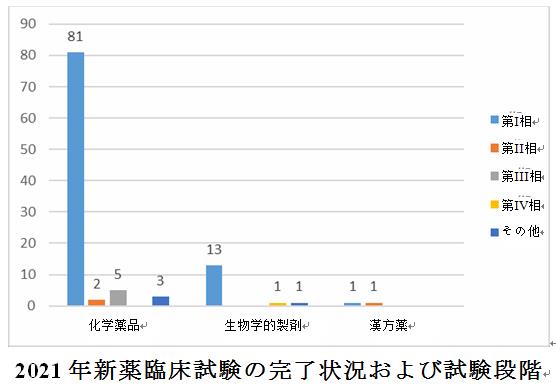
国内試験の終了日と最初の国内ICFの署名日に基づいて臨床試験の完了にかかる時間を分析し、完了期間は13日から244日の範囲で、平均は80.9日であった。試験段階に従って完了時間を分析すると、第I相臨床試験の平均期間は最短で74.1日、第IV相臨床試験の平均期間は最長で244日であった。
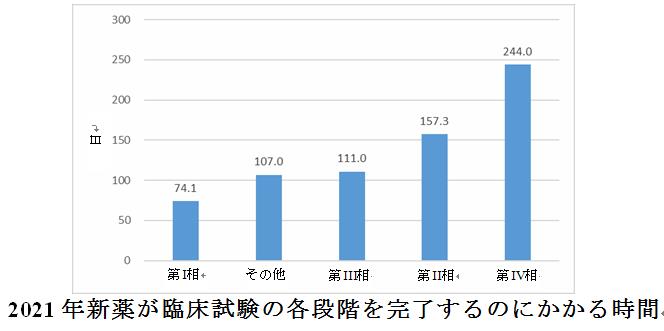
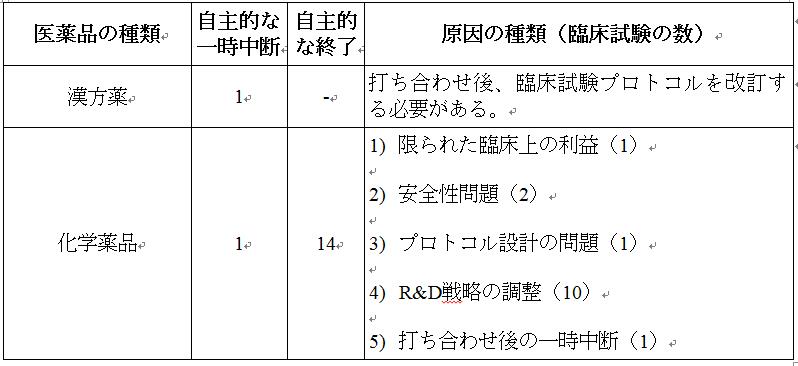
試験の一時中断または終了日の分析によると、2021年に、自主的な一時中断が6件(化学薬品1件、生物学的製剤4件、漢方薬1件)で、自主的な終了が18件(化学薬品14件、生物学的製剤4件)であり、一時中断や終了の理由は次の通りである。

過去3年間のデータ分析によれば、同年に完了した臨床試験のうち、化学薬品の第I相臨床試験が主なものであり、2019年から2021年までそれぞれ69.6%、61.2%、75.0%を占めた。試験段階ごとの完了期間の分析によると、第I相臨床試験の期間は比較的短く、74.1日から95.7日までの範囲であった。2021年の一時中断および終了した試験の総数は、2019年および2020年のそれよりも大幅に多く、一時中断および終了の理由のうち、R&D戦略の調整が50%(12 vs. 24)を占めた。試験段階の分析によると、試験が第I相で自主的に終了の割合が37.5%(9 vs. 24)、最も高かった。さらに、試験の12.5%(3 vs. 24)が第III相で自主的に終了した。これには、陽性結果が得られなかった1つの中間解析が含まれる。
第四章 直近3年間の新薬臨床試験の傾向特性
一、新薬の臨床試験の数は大幅に増加しているが、均質性は依然として比較的顕著
2021年には、医薬品臨床試験登録および情報公開プラットフォームの年間登録総数が初めて3,000を超えた。これは、プラットフォームが開始されて以来最高の年間登録数であり、2020年と比較して全体で約30%増加した。新薬臨床試験の割合も過去3年間で逐年増加し、2021年には60%を超えた。新薬の研究開発は依然として初期の臨床試験によって支配され、第I相臨床試験が全て40%を超え、最も高い割合を占めた。
2019年から2021年まで、化学薬品と生物学的製剤の臨床試験は主に抗腫瘍薬であり、この数年間で30%以上および40%以上を占めた。2021年には、化学薬品の抗腫瘍薬試験の数は抗感染症薬の5.3倍(422 vs. 79)であった。生物学的製剤の抗腫瘍薬試験の数は予防ワクチン試験の3.1倍(406 vs. 131)であった。薬物作用ターゲットも比較的集中しており、中でもPD-1とPD-L1は特に顕著で、それらの第III相臨床試験の割合は他のターゲットよりも高かった。
二、漢方薬に関する臨床試験の数は少なく、実施効率の改善が必要
2019年から2021年まで、漢方薬に関する臨床試験の割合は低く、全体の4%未満であった。漢方薬の臨床的適応も比較的集中している。過去3年間のデータは、呼吸、消化、心血管、精神神経の4つの適応症に集中し、合計量が数年間漢方薬臨床試験の総数の60%を超えたことを示している。漢方薬臨床試験の実施効率は、承認後も改善する必要がある。2021年の登録データによると、90%近くの臨床試験が1年以上被験者の募集に時間を要し、臨床試験の開始には長い時間がかかることがわかる。
三、特別な集団における医薬品の臨床試験を重視すべき
2021年には、高齢者のみを対象に合計3つの臨床試験が実施され、漢方薬、化学薬品、生物学的製剤のそれぞれ1つで、全体のわずか0.1%を占めた。小児のみを対象に実施された臨床試験は全体の2.9%を占め、主に生物学的製剤の予防ワクチンを中心とし、他の適応領域での試験数もわずか1~5件であった。過去3年間のデータを比較および分析すると、2021年は2019年および2020年と比べて全体的な傾向に大きな変化はなかった。
「希少疾患リスト(第1期)」に含まれる121の疾患によると、過去3年間の臨床試験データの分析から、希少疾患の臨床試験の数と適応分野は逐年増加の傾向を示したが、リストに含まれる疾患の国内臨床試験は未だ比較的少ない。現在の希少疾患の臨床試験では、神経疾患は主に多発性硬化症と視神経脊髄炎スペクトラム障害であり、血液系疾患は主に血友病、そして呼吸器系は主に特発性肺線維症である。
四、臨床試験の不均一な地理的分布は比較的顕著
2021年に、北京市の臨床試験実施機関がチームリーダーユニットとして臨床試験に参加する回数は、全体の約1/5を占め、これは2020年と一致している。2019年から2021年までのデータを包括的に分析すると、臨床試験チームリーダーユニットの数が最も多い上位5位の省と市は、常に北京市、上海市、広東省、江蘇省、湖南省であり、長年にわたって合計の半分以上を占めている。臨床試験の開始効率の分析と組み合わせると、臨床試験チームリーダーユニットが多い省、区、市では、臨床試験の開始に費やされた時間が比較的長く、一方、臨床試験チームリーダーユニットが少ない個々の省では、臨床試験の開始効率が比較的に高い。
添付文書:作成についての説明
1. この報告書は、2021年1月1日から2021年12月31日まで(最初の公開日)の期間の医薬品臨床試験登録および情報公開プラットフォーム(以下、「登録プラットフォーム」という。)のデータベース内の臨床試験登録情報を検索すると同時に、業界で公開されているデータベース検索情報を参照し、臨床試験登録番号(CTR)で統計的記述と分析を行い作成したものである。依頼者は重複登録情報等を削除する場合があるため、報告書に掲載されている臨床試験の数量情報は、医薬品審査評価センターのウェブサイトに掲載されているリアルタイムデータとは若干の差異が生じることがある。
2. この報告書は、主に新薬臨床試験(受入番号で登録された探索的および検証的臨床試験)の登録情報を要約および分析し、生物学的同等性試験(後発医薬品の品質および有効性の一貫性評価を含む)については、全体的な概要分析と説明のみを提供する。
3. この報告書では、臨床試験登録情報が主に、医薬品の種類(漢方薬(天然薬物を含む)、化学薬品、生物学的製剤)、登録分類(元の登録分類情報を含む)、適応症、薬物ターゲット、臨床試験段階、および試験の進行状況に従って分類および分析される。医薬品審査評価センターの年次医薬品審査評価報告書を参考にし、適応症の分類などを統一している。
4. この報告書の特別な集団における医薬品の臨床試験では、小児集団は14歳以下の被験者として定義され、高齢者集団は65歳以上の被験者として定義されている。
5. 希少疾患については、2018年5月11日に国家衛生健康委員会と他の5つの部門が共同で作成およびリリースした「希少疾患リスト(第1期)」を参照する。



 ホーム
ホーム 最新情報
最新情報 機構紹介
機構紹介 国際交流
国際交流 サイトについて
サイトについて