国家医薬品監督管理局は、医薬品上市許可保有者(医薬品許可証明書類を持つ医薬品メーカーを含む。以下「保有者」と略称する。)が医薬品安全関係主体的責任を果たすよう促進し、保有者の職責遂行能力を高め、保有者による臨床安全性文献の全面的評価を規範化させるために、「上市した医薬品臨床安全性文献評価ガイドライン(試行版)」を制定し、2019年6月18日に発布した。
上市した医薬品臨床安全性文献評価ガイドライン(試行版)
一、概要
国家医薬品監督管理局による「医薬品上市許可保有者による副作用直接報告関係事項の公告」(2018年第66号)の第四款に基づき、保有者が医薬品副作用モニタリングのデータ、臨床研究、文献などの資料を定期的に評価しなければならない。上市医薬品臨床安全性文献の評価は医薬品上市後における臨床研究の主要方法の一つで、一定期間内で、特定した上市医薬品の臨床安全性研究関係文献をなるべく全面的に収集し、文献資料の選定、有効的資料の抽出、品質評価と総括整理を行った上で、定性または定量総合分析と評価を行い、評価報告書を作成するプロセスである。基本要素は文献評価の一般的流れ、方法学的要点および評価報告書作成要項である。
本ガイドラインは根拠に基づく実証医学の証拠分類、分級、評価厳格化と継続的更新という理念と方法を参照にし、衛生技術総合評価指標と形式を参考とし、Cochraneシステム評価規範化実施手順と全過程品質制御の方法を導入し、医薬品上市許可保有者(以下「保有者」と略称する。)による上市した医薬品(漢方薬、化学医薬品とバイオ医薬品を含む)の臨床安全性文献評価と文献評価報告書作成を指導する旨である。
二、方法学的要点
(一)一般的流れ
文献評価一般的流れは図1を参照するように。
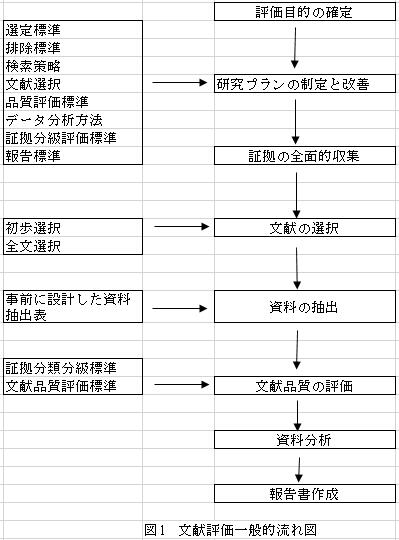

1、評価目的の確定。管理部門の要求事項または保有者自身のニーズに基づいて研究目的を明確する必要がある。実証医学PICOSフォーマットの使用ができて研究課題を明確化し、評価目的を確定し、評価業務の目的性と研究の能率を高める。PICOSは研究対象(Patient/Population)、干渉措置(Intervention)、対照措置(Comparison/Control)、結果指標(Outcome)和研究設計(Study design)の英語頭文字の組み合わせである。
2、研究プランの制定。研究プランは文献選定標準、文献排除標準、検索策略、文献選択、原始的研究品質評価プラン、有効情報抽出プラン、統計分析計画、証拠ランク評価プランおよび副作用関係専門用語標準化プランを含む。検索策略は検索用データベース、検索範囲(テーマなど)、検索キーワード、検索方式(キーワード組み合わせ方式)と期間などを含むべきで、研究目的によって定める必要がある。
3、証拠の全面的収集。確定した検索策略によって、各種有効ルート(電子検索または手動検索)で証拠を全面的に収集する。データ資料は常用データベース、専門データベース、政府系ウェブサイト、会議議事録、学術論文集およびその他未公開文献などである。常用データベースと関係ウェブサイトは付録(一)を参照するように。言語制限を設けず、中国語と外国語データベースを全面的に検索するよう推奨する。証拠の調べで文献の言語、期間、設計類型などの制限を設けた場合、報告書で明記しなければならない。未公開の文献、即ち「灰色文献」(会議で発表された論文、未発表の学位論文、産業報告書、コンサルティング報告書)も収集しなければならない。灰色文献は陰性研究結果を含む可能性があるため、それらの結果は通常、発表される機会が小さいにもかかわらず、文献評価で灰色文献を無視して公開された文献だけを取り扱うなら、偏差が生じうる。
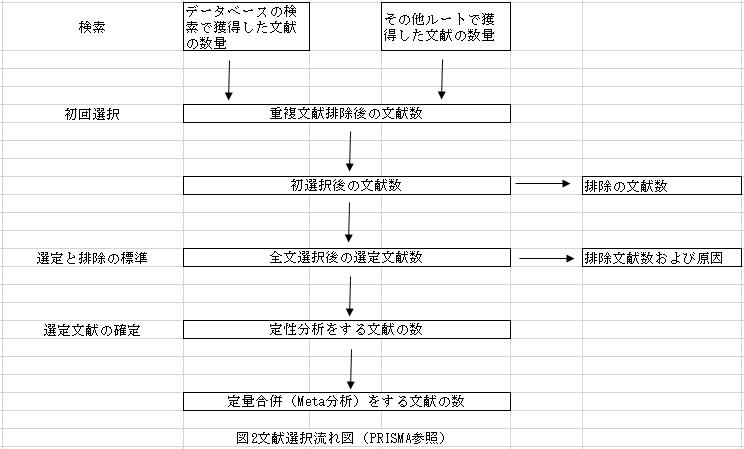
4、文献の選択。研究目的によって文献選定と排除標準を確定し、選定と排除標準に従って文献を選択し(文献選択の流れは図2参照。)、選定した文献の量、排除した文献の量と理由を説明しなければならない。文献選択は普通、初歩選択(テーマと概要で選択)と全文選択(全文を詳細に閲覧して選択)の2つのステップになる。

5、有効資料の抽出。研究目的、注目されている問題、分析予定内容など基づいて有効資料抽出表を設計し、表の内容が詳細で合理的でなければならない。有効資料抽出表の設計にあたって、実証医学PICOS原則、品質評価方法関係要求事項を参考とし、詳細事項については付録(二)を参照するように。抽出すべき資料は文献の一般状況(番号、テーマ、著者、出所、出版時間など)、研究PICOS情報、文献品質情報(研究設計類型と偏差。例えば、データ収集が合理的かどうか、分析方法が適当であるかどうかなど )、主要結果に関する資料およびその他情報(例えば、保有者が資金援助を行ったか)などである。資料抽出表の設計を完了した後、抽出のトライを行い、その結果によって適当に調整、改善する。
6、文献品質評価。文献品質評価は文献研究における不可欠な重要部分である。文献品質評価基準は付録(三)を参照するように。原始的文献の品質が低いなら、文献評価も高い品質な総合分析結果を出せない。文献品質評価は方法学的品質評価と報告書品質評価を含む。前者は偏差リスク評価、即ち原始的研究の信憑性評価で、後者は報告書の完全性と透明性に関する評価である。この両者に関しては、多くの機関が国際的に公認され、異なる研究向けの評価表とリストを制定した。研究者が自らの研究目的によって相応しいツールを選択しなければならない。
7、資料分析。資料の具体的な状況によって、定性または定量分析の方法を使用する。定性分析とは記述的なまとめが研究結果として入選する方法である。表の形で選定した研究の特徴と結果を比較してまとめることができる。定量分析とは統計学的方法で入選した研究結果を分析する方法である。異質性検査、Meta分析、敏感性分析およびサブグループ分析などを含む。選定した研究の異質性が大きい場合、サブグループ分析とMeta回帰で異質性の由来を探ることができる。異質性が依然として軽減できない場合、定量分析が適用しない。研究主要結果の安定性を評価する必要がある。この場合、通常は敏感性分析方法を使用する。一般的には、副作用/事象が比較的に少なく、「0」になっている場合、Meta分析で「0」の代わりに「0.5」として計算する。文献品質評価で原始的研究の品質が普遍的に高くなく、偏差も大きく、評価のニーズを満たさず、もしくは既存問題を解決できないと発覚した場合、文献検索の策略を調整してあらためて証拠を検索し(但し、最終報告書で説明しなければならない)、もしくは業務の実際のニーズに基づい次の研究計画を制定できる。
8、文献評価報告書の作成。文献評価報告書はどのようなレベルの証拠で結論を出したか説明すると同時に、結果の外挿可能性も説明しなければならない。証拠分級基準は付録(四)を参照するように。文献評価報告書の作成にあたって、総合記述とMeta分析結果優先報告の項目(Preferred Reporting Items for Systematic reviews and Meta-Analyses, PRISMA)、流行病観察的研究のMeta分析(Meta-analysis Of Observational Studies in Epidemiology,MOOSE)、PRISMA声明とMOOSE声明(付録(五))を参照できる。
(二)安全性文献評価の注意事項
1、安全性文献評価は研究対象となった医薬品に関する国内外文献資料をすべて検索しなければならない。具体的には、医薬品安全性を研究目的とする資料、医薬品有効性を主要研究目的とする資料、実施中(中間研究結果を獲得した)または完了したが、結果を発表していない臨床研究(灰色文献)および副作用個別症例の報道などである。
2、安全性文献評価は観察的研究の結果に重点を置くべきである。ランダム化対照試験と非ランダム化対照試験も評価対照とすべきである。観察的研究はコホート研究、症例対照研究、現況研究、生態学的研究、症例シリーズ、症例報告およびそのた派生的流行病研究の類型(症例交差研究、症例時間対照研究など)を含む。
3、具体的な状況によって類型が異なる研究の品質を評価しなければならない。評価の内容は主に研究設計、実施、統計分析と結果報告などである。評価を行う際に、原始的文献に存在する可能性がある偏差と偏差制御に重点を置くべきである。医薬品安全性文献評価の結論を出す際に、文献品質評価の結果を考慮に入れなければならない。
4、安全性文献評価の資料抽出表は文献評価の一般的内容以外には、副作用/事象発生状況、医薬品使用状況、医薬品併用状況、副作用/事象の変化、関連性評価なども含まなければならない。原始的研究論文著者の医薬品副作用/事象に対しての判断を尊重しなければならない。
5、安全性文献評価は記述的分析方法で安全性資料をまとめ、表の形で結果を報告できる。
6、文献資料における重篤副作用/事象に関しては、個別症例の情報を獲得できるなら、症例別に詳細状況を記述しなければならない。記述の内容は患者の人口学的基本特徴、症状、診療過程、医薬品併用状況、副作用/事象の発生プロセス、処理方法と結果を含まなければならず、それ限りではない。重篤症例に関しては、資料がすべてそろっているかどうか、因果関係が成立するかどうかを評価すべきである。因果関係の判断原則に従って慎重に分析を行い、結論を出さなければならない。個別症例のまとめと分析も行わなければならない。
7、企業が実施し、もしくは資金援助を行った上市した医薬品臨床安全性文献評価の場合、医薬品副作用モニタリングデータの分析を行わなければならない。モニタリングデータの分析は医薬品安全リスクの兆しに重点を置かなければならない。個別症例の報告で細かい情報(例えば、医薬品のロット番号)が実際の状況と異なる場合、当該報告を排除してはならない。医薬品副作用モニタリング関係ガイドラインに準じて医薬品副作用の名称を規範化させ、副作用/事象の因果関係を評価しなければならない(評価基準は図3参照)。モニタリングデータの分析結果に基づき、モニタリングデータの分析結果と医薬品添付文書における安全性情報の差異を分析し、新型且つ重篤な副作用の状況を検討し、リスク制御措置をとるかどうかを議論し、リスクとメリット評価の結論を出す。
8、副作用/事象の発生率を慎重に計算する。医薬品安全性関連事件の重要性と影響を評価するにあたって、副作用/事象の発生率および重篤さを総合的に評価し、安全性評価の結果を説明しなければならない。安全性文献評価を行った上で、医薬品の有効性に基づき、リスクとメリット評価の結論を出す。
9、発表された関係全面的評価の結論、Meta分析の結果と比較し、選定と排除標準、選定した文献の範囲、干渉、対照、結果、データ分析方法と結論を含まなければならず、それ限りではない。


10、文献評価のメリットと制限性を明確に分析しなければならない。
11、選定した文献のリストおよび全文選択段階で排除した文献のリストを提供し、排除原因を説明しなければならない。
(三)品質制御の注意事項
1、研究を本格的に行う前に、完全な研究プランを制定しなければならない。保有者が研究プランに厳格に従って研究を展開するよう推奨する。研究プランと異なる場合、説明しなければならない。保有者が研究プランの登録を行うよう推奨する。
2、文献検索、選択、有効資料抽出、品質評価とデータ入力のプロセスで、2名の評価員が独立して別々に作業を行うよう推奨する。文献初選択の段階で、2名の評価員のうち、1名が選定を認めるなら、当該文献を選定するべきである。文献全文選択、有効資料抽出と品質評価の段階で、2名の評価員の意見が異なるなら、協議してコンセンサスを得るように。コンセンサスを得なかった場合、第三者による裁きが必要である。kappa値等、文献選択、資料抽出と品質評価で、2名の評価員が出した意見について記録して評価するよう推奨する。
3、あらゆる関係研究の情報をなるべく獲得するよう推奨する。発表した文献から十分な情報(例えば、研究方法の重要なディテール、研究結果における主要データ)を獲得できなかった場合、著者に関係資料の提供を求める必要がある。保有者が実施し、もしくは資金援助を行った灰色文献は研究対象に選定する。その他灰色文献をなるべく獲得する。
4、検査に備えて関係原始的資料を保存するよう推奨する。具体的には、検索策略、各データベースの検索記録(例えば、期間、検索策略、検索結果など)、文献および項目別情報の保存(各データベース)、重複文献を削除する方法と結果、各文献選択職員が作成した文献選択表と全員が認めた文献選択結果、各資料抽出を担当する職員が作成した資料抽出表と全員が認めた資料抽出リスト、各品質評価員が作成した評価表と全員が認めた評価結果リスト、著者、保有者と研究チームのコミュニケーションと意思疎通に関する原始的記録である。
三、報告書作成要項
文献評価報告書の作成は要項に従って作成しなければならない。「医療衛生研究品質と透明性向上ネットワーク(Enhancing the Quality and Transparency of Health Research Network, EQUATOR)」のオフィシャルサイトは数百件の関係ガイドラインを集めた。そのうち、常用なものはPRISMA声明とMOOSE声明で、詳細は付録(五)を参照するように。この2つの声明はいずれもリストの形で類型別に原始的研究評価結果報告のフォーマットをまとめた。報告書を作成する際には、当該リストの項目を参照し、簡潔に、明晰に、如実に、完全に項目ごとに記述しなければならない。
文献評価報告書の本文は以下の内容を含まなければならず、報告書の書式は付録(六)を参照するように。
(一)背景および目的
課題選定の背景、根拠(重要性)および評価の目的を述べ、PICOS原則に従って研究と評価で解決する予定の問題を明晰に記述しなければならない。
(二)方法
文献選定と排除の標準、検索策略、文献選択、データ抽出、品質評価、資料処理とデータ分析について記述する。
1、文献選定と排除の標準について。具体的には、選定と排除した研究類型、研究対象、干渉措置、結果関係指標(主要指標、副次指標の説明が必須。代替指標があれば、説明する)である。文献排除標準は文献選定標準より優先する。具体的には、どのような研究が分析基準に適合せず、排除された説明する。
2、文献検索策略について。具体的には、検索ルート、検索用データベース、検索期間および検索方式である。検索に制限を設けたか(例えば、言語制限)、手動検索を行ったか、灰色文献を検索したかなど、重要な問題を説明しなければならない。
3、文献選択について。具体的には、文献選択の流れ、結果と品質制御である。2名の評価員が独立して別々に文献選択を行ったか説明しなければならない。また、2名の評価員の意見が分かれた場合、いかにコンセンサスを得て問題を解決したのかについても説明しなければならない。
4、有効資料抽出について。具体的には、有効資料抽出の方法と抽出した内容について説明する。2名の評価員が独立して別々に資料を抽出したか説明しなければならない。また、2名の評価員の意見が分かれた場合、いかにコンセンサスを得て問題を解決したかについても説明しなければならない。
5、品質評価について。具体的には、評価のツール/基準を説明し、または参考文献をあげる。2名の評価員が独立して別々に品質評価を行ったか説明しなければならない。また、2名の評価員の意見が分かれた場合、いかにコンセンサスを得て問題を解決したのかについても説明しなければならない。
6、資料処理と統計分析について。具体的には、データ処理の方法を説明する。定量合成プロセスがあれば、どのような合成方法と統計分析方法を使用したのかを説明しなければならない。
(三)結果
研究の主要成果を述べる。具体的には、文献検索の結果、研究の特徴と品質評価の結果、データ合併の結果である。
1、文献検索結果について。初検索で検出した文献の量、最終的に選定した文献の量を記述し、文献選定流れ図を作成し、排除した文献の量と排除原因を直観的に表す。
2、研究の特徴と品質評価の結果について。表の形で、研究の特徴および品質評価の結果を直観的に表す。研究の特徴をまとめる表は通常、研究年数、地域、サンプル量、対象群、研究類型、干渉措置、対照措置、結果指標、効果と信頼区間および品質評価結果などを含まなければならない。
3、データ合併の結果について。評価指標を項目別に整理して報告する。定量研究資料は異質性検査をへて合格したなら、合併して分析を行い、分析の結果を報告する。定性資料は同質性によって分類、総括、整理し、分析の結果を報告する。定量合併は効果と信頼区間を説明し、フォレストプロットを提出する。
(四)議論
議論は結果の分析で、結果の重複記述ではない。議論は研究目的をめぐって行い、以下の内容を含まなければならない。主要結果の発生原因と意義、文献証拠品質および研究結果への営業、評価の品質、偏差制御および限界(関係研究を選定したかどうか、関係資料を獲得したかどうか、現在の方法で偏差を招くかどうかなど)、研究結果とその他類似研究または評価結果の異同、著者による結論、推薦した証拠のレベル、評価の限界および今後における類似研究の展開と評価への改善建議。
四、本ガイドラインの参考文献(略)
五、付録(略)
(一)常用データベースと関連ウェブサイト
(二)文献資料抽出表(参考用)
表1 RCT研究文献特徴まとめ表
表2 臨床試験、コホート研究における副作用/事象発生状況情報表
表3 症例シリーズ、横断面研究における副作用/事象発生状況情報表
表4 副作用/事象個別症例基本情報表
(三)文献品質評価基準
表5 文献品質評価表(RCT品質評価を例として)
(四)証拠分級基準
表6 GRADE証拠4レベルの意義
表7 GRADE証拠品質分級法とまとめ
(五)PRISMA声明とMOOSE声明
表8 PRISMA声明
表9 MOOSE声明
(六)報告書フォーマット(略)
(出所:国家医薬品監督管理局サイト2019-06-18)



 ホーム
ホーム 最新情報
最新情報 機構紹介
機構紹介 国際交流
国際交流 サイトについて
サイトについて