为进一步加强药品注册管理工作,经过广泛调研和深入研究,国家食品药品监督管理总局药品化妆品注册管理司对《药品注册管理办法》部分条款进行了修订,2013年11月12日以修正案的形式公开征求意见。通知要求,各省、自治区、直辖市食品药品监督管理局要认真组织辖区内药品生产企业和研发机构研究讨论,书面意见于2013年12月13日前反馈药品化妆品注册管理司。其他单位或人员的意见请于同一时间前反馈。
意见反馈方式如下:
1.书面意见(邮寄地址:北京市西城区宣武门西大街26号,邮编:100053,国家食品药品监督管理总局药化注册司)。
2.电子邮件(yjjdc@sfda.gov.cn)。
联系方式
联系人:李金菊、何佩恒
电 话:(010)88330720、88330732
附件1:
《药品注册管理办法》修正案(征求意见稿)
起草说明
一、修订背景
《药品注册管理办法》(国家食品药品监督管理局令第28号,以下简称“注册办法”)自2007年10月1日实施以来,对规范药品注册行为,鼓励新药创制,提高新药研发水平,促进药品可获得性,保障药品安全、有效和质量可控等方面取得了显著成效。但是,在实施过程中也出现了一些与新形势新要求不相符的情形,需要对部分条款予以修改。
二、修订内容与说明
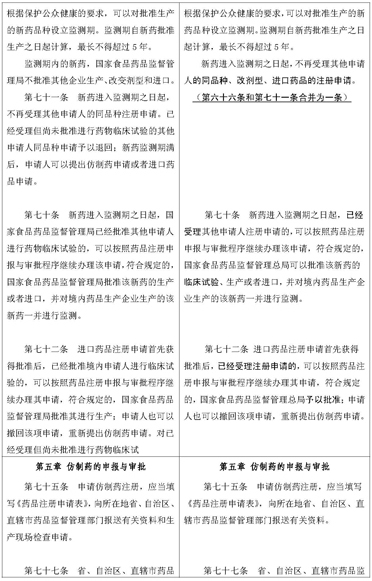
(一)关于增加适应和鼓励药物创新的条款。近年来,随着鼓励药物创新政策的实施,新药研发不断增多,一些申请人在新药临床试验期间需要对处方、工艺、生产场地以及批件持有人进行变更,但现行注册办法中未对上述几种情形做出相应的规定,使得申请人无法变更相应内容,影响了新药研发。为此,增加新药临床试验期间变更相关事项的内容和条款,有利于申请人在新药临床试验期间按着实际状况变更有关事项,使新药研发更加科学合理。
(二)关于与专利法衔接条款的修订。2008年修订的专利法对不视为侵犯专利权的情形做出规定,而现行注册办法与新修订的专利法没有衔接,在一定程度上延迟了我国仿制药的上市,变相延长了专利保护期,为此删除第十九条,与专利法衔接条款的修订有利于提高我国公众用药的可及性。鉴于在药品注册过程中已不存在专利侵权问题,故对第十八条第二款做文字的修改,将原“药品注册过程中”的描述修改为“药品上市后”,明确药品上市后发生专利纠纷的处理原则。
(三)关于完善监测期管理相关条款的修订。既往对监测期的管理,在新药进入监测期后,对已受理尚未批准临床试验的同品种均予退回,引发了诸多矛盾。为此修订相应条款,将现行注册办法第七十一条中的“已经受理但尚未批准进行药物临床试验的其他申请人同品种申请予以退回”删除,规定凡是已受理的注册申请,均可以按照药品注册申报与审批程序继续办理。
(四)关于仿制药注册生产现场检查程序调整条款的修订。为了保证仿制药申报资料的真实性,现行注册办法规定仿制药注册生产现场检查在批准临床试验前实施。而事实上,仿制药的工艺处方需要根据生物等效试验结果调整优化,最后确定申报工艺处方。且批准临床试验前进行生产现场检查存在投入资源多、效率低、检查质量不高等问题,并与技术审评、GMP检查脱节。为此,将仿制药生产现场检查调整到完成临床试验和技术审评后,上市许可前进行,这更加符合仿制药的研发规律,实现技术审评与生产现场检查相结合,提高现场检查的效率和质量,也减轻申请人接受多次检查的 负担。
(五)其他
1. 为规范非临床安全性评价研究,提高研究质量,修订第二十二条,要求所有非临床安全性评价均在获得《药物非临床研究质量管理规范》认证的机构进行。
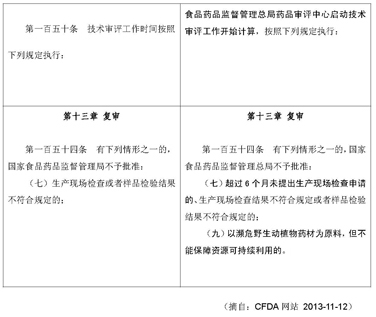
2. 为了准确表述技术审评时限,修订第一百五十条审评工作时限的描述,明确技术审评时限从国家食品药品监督管理总局药品审评中心启动技术审评工作开始计算。
3. 为保证中药资源的可持续利用,保护濒危野生动植物,在第一百五十四条不予批准的内容中增加“以濒危野生动植物药材为原料,但不能保障资源可持续利用的”的规定。
4. 为完善生产现场检查的管理措施,在第一百五十四条不予批准的内容中增加 “超过6个月未提出生产现场检查申请的”的规定。
5. 根据新一轮国务院机构改革后我局的机构名称,现行注册办法中凡是“国家食品药品监督管理局”均改为“国家食品药品监督管理总局”;“中国药品生物制品检定所”均改为“中国食品药品检定研究院”。
综上,此次注册办法的修订共修订12项条款,删除1条,合并1条,新增4条。
附件2:
《药品注册管理办法》修正案(草案)征求意见稿
2013-11-13



(摘自:CFDA网站 2013-11-12)



 首页
首页 最新动态
最新动态 机构简介
机构简介 国际交流
国际交流 关于我们
关于我们 京公网安备 11010802027110号
京公网安备 11010802027110号