2013年2月28日、国家食品医薬品監督管理局医薬品審査センターは、「2012年度中国医薬品審査報告」を発表した。同報告書によると、国家食品医薬品監督管理局による革新促進、審査資源の合理的な配置という戦略は効果を見せ始め、抗癌剤のBMS-817378などは海外と同時に臨床応用の批准を取得し、一部の重要な臨床価値を持つ輸入医薬品は国内外発売の時間差を著しく短縮できたという。
2012年、国家食品医薬品監督管理局医薬品審査センターは、薬物研究・開発の規律によって、審査と評価の戦略を積極的に調整し、革新促進とリスク制御の作用を共に発揮させ、独創的な研究と開発に対する奨励を行い、臨床で不足しているジェネリック医薬品の研究と開発を促進した。それと同時に、情報公開に一層力を入れ、社会からの監督を受けた。自身の業務能力を高めるために、評価メガニズムを取り入れ、量的な指標とデータで業務の能率を評価し、管理制度と審査プロセスを確立し、専門的な審査制度の骨格をつくった。
2012年度医薬品登録申請受理と審査の状況を見ると、独創性のある薬物臨床試験申請の審査待ち時間はやや短くなり、約4カ月という水準を保っている。発売後補充申請の受理待ち時間も、2012年初頭の5カ月から、2012年終わりには3カ月へと短縮した。2012年に国内の申請者が行った化学医薬品と新薬の臨床試験申請の多くは、審査所要時間(審査待ち時間を含む)が8カ月以内で72%を占めた。6-7カ月かかったものが最も多くて45%を占め、5カ月以内だったものは11%、9カ月以上かかったものは、その多くが複方関係の申請で15%を占めた。治療分野を見れば、抗癌剤の所要時間が最短だった。専門的な審査の所要時間を見れば、薬学的な審査の所要時間は明らかに短くなった。2012年に審査された臨床試験実施品目は、2012年5月に薬学的な審査と年間報告制度が実施される前に審査の平均所要時間が7カ月だったものが、その後、薬学的な審査の時間が短縮され、年末の時点で、4-5カ月になった。国内の申請者がグローバルに同期した研究と開発を行うことを促進するために、国家食品医薬品監督管理局医薬品審査センターはその申請に対する審査を加速させた。BMS-817378とHS-25などは国外でも国内と同時に臨床応用の批准を得た。
一部の外国先発輸入医薬品は、我国では満たせない臨床ニーズへの対応と最新治療手段の提供で重要な役割を果たしている。医薬品審査センターは我国の公衆がいち早く世界最新の医薬品を利用できるよう促すために、国内における臨床特需な輸入医薬品の審査に注目している。審査と評価の資源の合理的な配置によって、重要な臨床価値を持つ輸入医薬品の国内外発売の時間差の縮小に努める。例えば、スニチニブリンゴ酸塩カプセル(Sunitinib Malate Capsules)(新しい適応症)、クリゾチニブカプセル.(Crizotinib Capsules)、リルピビリン塩酸塩タブレット(Rilpivirine Tablets)、チカグレロルタブレット(Ticagrelor Tablets)などの場合、2012年に国内での発売批准を取得した。それはアメリカ食品医薬品局(FDA)による発売批准より、わずか1年遅れたに過ぎない。
2012年、医薬品審査センターの審査によって、我国は多くの重要治療分野の医薬品を批准した。エイズ治療の分野では、リルピビリン塩酸塩タブレット(Rilpivirine Tablets)が批准され、我国のエイズ患者が全世界と同時に最新の治療手段を手に入れられるようになった。児童用医薬品の分野では、身体障害を起こしたり命を落としたりする可能性のある未熟児呼吸中止症の治療に有効な唯一の医薬品、安息香酸ナトリウムカフェイン(Caffeine Citrate Injection)が批准された。癌治療の分野では、里程標的な意味を持つクリゾチニブ・カプセル(Crizotinib Capsules)が批准され、ALK融合遺伝子陽性非小細胞肺癌の分子標的治療に使用された。稀有な病気の分野では、国産デシタビン注射剤(Decitabine for Injection)注射剤が批准され、珍しい病気とされる骨髄異形成症候群(MDS)の治療に新たな選択肢を提供した。老年病の分野では、インダカテロールマレイン酸塩(Indacaterol Maleate Powder for Inhalation)粉末吸入器が批准され、慢性閉塞性肺疾患(COPD)の治療で活用され、患者が便利に医薬品を使用できるようにした。また、国産の認知症治療有効薬、メマンチン塩酸塩内服液(Memantine Hydrochloride)も批准された。抗感染剤の分野では、注射用チゲサイクリン(Tigecycline)が批准され、その国産化が耐薬品性感染症治療の重要な準備だった。この抗生物質を資源として保護するために、審査では添付文書における使用範囲を明確に限定し、臨床における濫用を防止した。リウマチ治療の分野では、フェブキソスタット錠剤(Febuxostat Tablets)が批准され、痛風患者への有効で安全、受け入れやすい新治療手段を提供した。過去の数年間、医薬品審査センターは代替フロン推進剤の使用をサポート、促進してきた。2012年は国産の代替フロン製品、オムナリス(Omnaris)吸入ステロイドの発売を批准した。これは我国が「オゾン層を破壊する物質に関するモントリオール議定書」の義務を履行するためにとった具体的な行動だった。バイオ製品の分野では、注射用血液凝固因子製剤IXが批准され、乙型血友病患者に特に効果的な医薬品を提供した。
報告書によると、2012年、医薬品審査センターは1年間で6919件の新規登録申請を受理したという(受理番号で算定)。過去の年間受理状況に比べると、2012年化学薬品関係の受理件数はやや増加し、漢方薬関係の受理件数は小幅に減少し、バイオ製品のほうは横ばい状態だった。国による革新促進政策の実施は医薬品の申請で初期的な効果を上げた。創新医薬品1.1類の受理されたプロジェクトは、2009年の42件から2012年の78件に増加した。ここ3年間、年間平均で7-8種の1.1類新薬が発売された。
また、報告書で示されたように、ジェネリック医薬品(4-6類)の登録申請は徐々に理性的に行われる状態に戻った。2007年は登録申請が2万件もあったが、2012年は1852件になった。しかし、ジェネリック医薬品の重複研究・開発、重複申請の現象は依然として深刻で、工業化が十分できていない問題は現在のジェネリック医薬品の研究と開発で顕著になっている。
2012年度の受理と審査状況
2012年、医薬品審査センターは1年間で6919件の新規登録申請を受理した(受理番号で算定)。過去の年間受理と審査業務との比較の結果は図1の通りである。
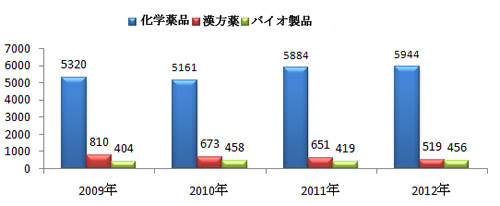
図1 各年度受理と審査業務の実施状況(2009年から2012年まで)
図1で示されているように、各年度の年間受理件数は6500-7000件の間を上下している。そのうち、最近の2年間はやや増加の傾向を見せた。2012年、化学医薬品関係の受理件数はやや増加し、漢方薬関係の受理件数は小幅に減少、バイオ製品関係の受理件数は横ばい状態だった。ここ数年、化学医薬品関係の受理件数は各年度受理総件数の80%-85%を占めていた。
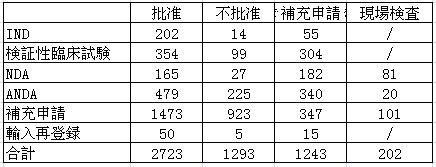
2012年、医薬品審査センターは審査済み、国家食品医薬品監督管理局に提出した審査任務は4941件であった。そのうち、批准されたのは3323件で、批准されなかったのは1618件だった。2012年医薬品審査センターは審査業務の受理量と完成量との差額が約2000件で、主に化学医薬品に集中していた。
2012年年末の時点で、国家食品医薬品監督管理局による批准状況は以下の通りである。(補充申請を除く)。
表1:2012年度批准された医薬品状況
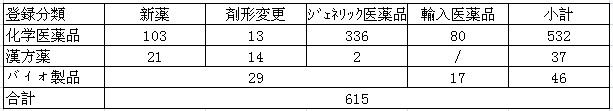
注:受理番号で算定(以下も同様)。
表2:2012年度薬物臨床研究批准状況
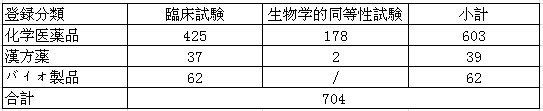
以下は、化学薬品、漢方薬とバイオ製品それぞれの年間受理と審査に関するデータである。
(一)2012年化学薬品関係受理と審査の状況
1、化学医薬品新規登録申請の受理状況
表3:各種登録の申請件数
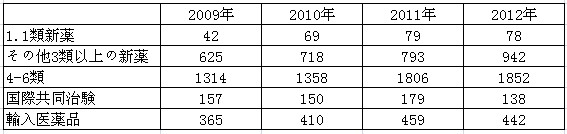
表3で示されているように、1.1類の申請件数は70件を維持、3類新薬の申請件数は毎年100件ほど増加していた。国による革新促進政策が初期的な効果を上げたことは、医薬品登録の状況からもうかがえる。
2011年、医薬品審査センターは国際慣例にのっとり、「医薬品審査センター審査業務管理規範」を実施し、審査業務を6通りのルートで管理した。以下のデータはいずれも審査管理のルートで計算されたものである。
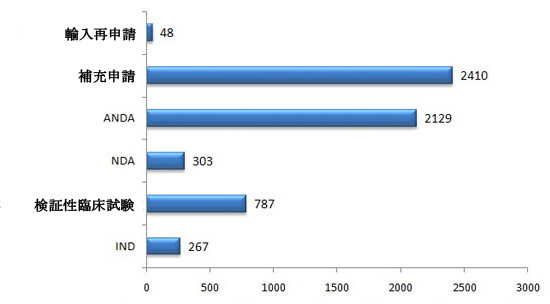
図2 2012年化学薬品関係申請の受理状況
2012年、化学薬品関係新規申請の受理件数は受理番号で算定すると、5944件だった。そのうち、新薬臨床試験の申請(IND)には、登録分類1や登録分類2、国際共同治験の臨床試験申請も含む。検証のための臨床試験申請は登録分類3と4の臨床試験申請に属する。新薬生産と発売申請(NDA)は臨床試験完了後の生産と発売のための申請である。ジェネリック医薬品及び変化した剤型の申請(ANDA)は登録分類5とされた。生物学的同等性試験の申請とその生産・発売の申請は登録分類6とされた。補充申請は発売された製品に関する変更申請だと定義された(そのうち、創薬のⅡ、Ⅲ期臨床試験の申請は補充申請の形で行われ、INDに分類された)。
2、IND申請治療分野の詳細
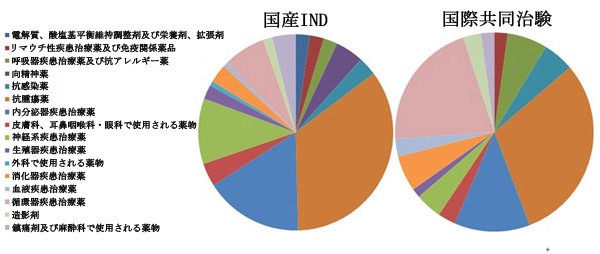
図3 2012年度化学薬品IND申請の詳細
国際共同治験臨床試験申請か国内のIND申請かを問わず、化学医薬品関係の申請で最大の割合を占めたのは癌治療分野薬物に関するものである。2012年に受理された、国内INDに分類される癌治療分野薬物関係申請のうち、テニ(teni)類チロシンキナーゼ阻害薬(Tyrosine kinase inhibitor)は申請総件数の64.7%を占め、2011年の割合とほぼ同じだった。
3、ジェネリック医薬品重複申請の状況

図4 2012年度医薬品批准書番号を取得した申請の件数
図4で示されているように、2012年度新規ANDA申請は合計で2095件だった(受理番号で算定、添加剤関係の申請は除外)。20件以上の批准書番号を取得した医薬品に関する申請は1272件で、2012年度ANDA申請の60.7%を占めた。10件以内の批准書番号を取得した医薬品に関するANDA申請は、その総件数の20.6%を占めた。このデータから分かるように、ジェネリック医薬品の重複研究・開発、重複申請の現象は依然として深刻だった。
また、2012年「挙手発言」品目に関する予備実験の実施状況(詳細は「中国通用名薬の発展と研究に関する報告書」を参照)から分かるように、現在のジェネリック医薬品の研究と開発では工業化が十分できていない問題が目立っている。予備実験実施品目の生産企業のうち、国家食品医薬品監督管理局による通知発表後の6カ月以内に生産現場の検査を申し込んだ企業は全体のわずか三分の一だった。
4、審査完成状況
2012年医薬品審査センターは5461件の化学医薬品関係審査を実施した(受理番号で算定。申請者が自主的に撤回した284件の申請は除外)。詳細は以下の表のとおりである。
表4:2012年度化学医薬品審査状況
審査が完了し、国家食品医薬品監督管理局の批准を得ようとした4016品目の化学医薬品のうち、不批准と結論を出されたものは32%を占めた。不批准率は3年連続でおよそ30%を保っている。

図5 2011年と2012年の各ルートで完了した技術審査状況に関する比較
注:技術審査が完了した品目には、国家食品医薬品監督管理局に送付して批准を依頼したものと生産現場の検査が通知されたものを含む。
図5で示されているように、IND、検証のための臨床試験、NDA、補充申請という4つのルートで審査を行われたものは、2011年に比べていくらか増加し、2012年ANDA関係審査の完了件数は2011年とほぼ同じだった。
5、審査所要時間について
表5:化学医薬品審査ルートにおける審査状況
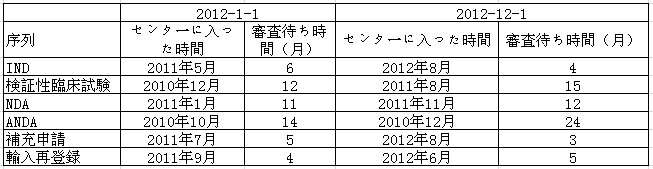
表5で示されているように、2012年、医薬品審査センターは全力をあげて、創薬の臨床試験申請に対する審査の円滑な実施を確保し、審査待ち時間を短縮させ、約4カ月という平均時間を維持した。発売後の補充申請の審査待ち時間も2012年初頭の5カ月から、2012年終わりには3カ月まで短くなっていた。しかし、ANDAの審査待ち時間は、初頭の14カ月から、年末には24カ月へと長くなっていた。それと同時に、NDAと検証のための臨床試験申請の審査待ち時間も長くなった。
5.1化学医薬品臨床試験申請の審査所要時間について
2012年度国内申請者による化学薬品IND申請の多くは、審査所要時間(審査待ち時間を含む)が8カ月以内だった(72%を占めた)。そのうち、6-7カ月かかったものが最も多くて45%も占め、5カ月以内だったものは11%、9カ月以上かかったものは複方申請が多く15%を占めた。治療分野を見れば、抗癌薬物の所要時間が最短だった。専門的な審査の所要時間を見れば、薬学的な審査の所要時間は明らかに短くなった。2012年に審査完了になったIND品目は、2012年5月に薬学的な審査と年間報告制度が実施される前に審査の平均所要時間が7カ月だったものが、その後、薬学的な審査の時間が短縮され、年末の時点で4-5カ月になった。国内の申請者がグローバルに同期した研究と開発を行うことを促進するために、国家食品医薬品監督管理局医薬品審査センターはその申請に対する審査を加速した。BMS-817378とHS-25などは国外でも国内と同時に臨床応用の批准を得た。医薬品審査センターの革新促進、審査資源の合理的な配置という戦略も効果を見せ始めている。
表6:各主要治療分野臨床試験申請の審査所要時間
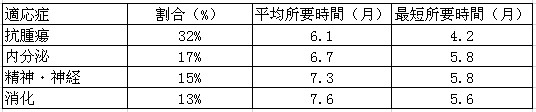
注:割合の小さい治療分野はあげられていない。表6のデータは本年度国内における47件の化合物IND申請によるものである。
5.2 輸入化学薬品の国内外発売批准取得時間に関する比較
一部の輸入医薬品は我国では満たせない臨床ニーズに応え、最新の治療手段を提供し、重要な役割を果たしている。医薬品審査センターは、我国の公衆がいち早く世界最新の医薬品を利用できるよう促すために、国内における臨床特需な輸入医薬品の審査に注目している。審査資源の合理的な配置によって、重要な臨床価値を持つ輸入医薬品の国内外発売の時間差の縮小に努める。例えば、スニチニブリンゴ酸塩カプセル(Sunitinib Malate Capsules)(新しい適応症)、クリゾチニブカプセル.(Crizotinib Capsules)、リルピビリン塩酸塩タブレット(Rilpivirine Tablets)、チカグレロルタブレット(Ticagrelor Tablets)などの場合、2012年に国内での発売批准を取得した。それはアメリカ食品医薬品局(FDA)による発売批准よりわずか1年遅れたに過ぎない。
(二)2012年度漢方薬関係申請の受理と審査状況
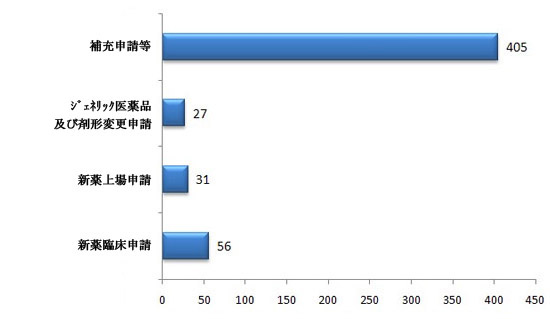
図6 2012年度漢方薬関係申請の受理状況
漢方薬関係新規申請は合計で519件(受理番号で算定)。
2、審査完了状況
2012年、医薬品審査センターは726件の漢方薬関係審査を完了した(受理番号で算定。申請者が自主的に撤回した72件の申請は除外)。詳細は下記の通りである。
表7:2012年度漢方薬審査の完了状況

3、審査所要時間について
現在、漢方薬関係申請の審査待ち時間は特に問題になっていない。
(三)2012年度バイオ製品申請の受理と審査状況
1、新規申請の受理状況
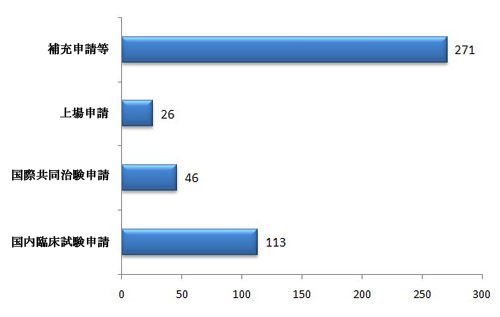
図7 2012年度バイオ製品申請の受理状況
バイオ製品関係新規申請は合計で456件(受理番号で算定)。
2、審査完了状況
2012年、医薬品審査センターは533件の審査を完了した(受理番号で算定。申請者が自主的に撤回した45件の申請は除外)。
表8:2012年度バイオ製品審査完了状況
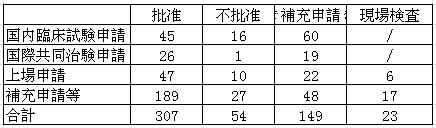
3、審査所要時間について
バイオ製品審査時間が長いという問題は依然として未解決のまま。
「2012年度中国医薬品審査報告書」の全文はhttp://www.cde.org.cnに掲載されている。
(出所:SFDAサイト、CDEサイト2013-02-28)



 ホーム
ホーム 最新情報
最新情報 機構紹介
機構紹介 国際交流
国際交流 サイトについて
サイトについて