2023年は、中国共産党第20回全国代表大会の精神を全面的に実施する最初の年であり、過去と未来を繋ぐ「第14次5ヵ年計画」の実行に向けた重要な年でもある。国家医薬品監督管理局は、習近平総書記の医薬品監督管理に関する重要な指示の精神を誠実に実行し、党中央委員会と国務院の決定と取り決めを断固として実行し、国の主要な医薬品政策の実施に貢献し、医薬品監督管理の実際のニーズと医薬品の生産?経営構造の動的な変化に焦点を当て、主要な戦略、主要な品目、主要なリンクの監督管理に焦点を当て、医薬品抜取検査を慎重に組織?実施し、引き続き医薬品の安全性ボトムラインを固め、医薬品監督管理の効率を向上させ、一部の生産、経営、使用、その他のリンクにおける医薬品の品質について全国的に抜取検査を実施ために各省(自治区、直轄市)の医薬品監督管理部門と関連する検査機関を組織し、市販後の医薬品の品質状況を評価し、偽造?粗悪医薬品の製造?販売を取り締まる。医薬品抜取検査管理システムを継続的に改善し、監督管理の制度的メカニズムと方法を常に革新することで、新しい状況の下で医薬品抜取検査作業を調整し、効率的に実行できる。2023年の国家医薬品抜取検査の結果は、我が国の現在の医薬品安全状況は概ね安定しており、制御可能であり、医薬品の品質は引き続き高水準を維持していることを示している。
一、概要
医薬品の市販後監督の重要な手段の1つである医薬品抜取検査は、リスク管理、科学的管理、及び事前監督管理を実現するための重要な技術的サポートである。長年にわたり、法律や規制の違反の取り締まり、違法企業の阻止、医薬品の品質の評価、業界基準の向上、医薬品のリスクについての国民への警告、科学的監督の支援において重要な役割を果たしてきた。2023年、「中華人民共和国医薬品管理法」と「中華人民共和国ワクチン管理法」を確実に実施するため、国家医薬品監督管理局は、「医薬品品質抜取検査管理弁法」及びその他の関連要件に従って、「四つの最厳」を遵守し、医薬品監督管理の実際のニーズに厳密に焦点を当て、主要なタスクに焦点を当て、運用メカニズムを改善し、監督管理方法を革新し、「分散サンプリング、集中検査、探索的研究、総合評価」の抜取検査モデルを採用する。全国31の省(自治区、直轄市)と新疆生産建設兵団を調整?組織し、階層的サンプリングモデルに基づいてサンプルを収集し、中国食品医薬品検定研究院を含む47の検査機関がサンプルの検査を担当する。潜在的な品質と安全性の危険性を明らかにするために、問題指向の医薬品品質研究及び評価システムを構築すると同時に、発見された問題をいつでも報告、判断し、対処できるようにリスク分類監督管理メカニズムの改善を継続する。さらに、医薬品抜取検査モデルを最適化することで、正確な監督管理、信用監督管理、スマートな監督管理を模索する。各省局を配置し、苦情や報告、ネットワークモニタリングなどに基づいてオンラインで抜取検査を実施し、オフラインとオンラインのさまざまな供給源からの医薬品に品質の違いがあるかどうかを調査する。中薬材の品質監視などの規制戦略を引き続き強化し、抜取検査サービス監督管理の有効性をさらに向上させる。
2023年の国家医薬品抜取検査は、1114社の医薬品生産企業、2528社の経営企業、511社の使用ユニットを含む、132品目の製剤と漢方飲片の合計18762ロットを完了した。検出された136ロットの規定に適合しない製品に対して、国家医薬品監督管理局は各省(自治区、直轄市)と新疆生産建設兵団の医薬品監督管理部門を組織し、速やかに適切なリスク管理措置を講じ、科学的な分析と判断を通じてリスクポイントを特定し、関係企業?部門を法に基づいて調査?処罰する。違法生産、品質管理レベルの低さ、医薬品の品質保証システムの欠陥などの問題を抱えた個別企業に対しては、リスクレベルに応じて追加査察、リスク警告、是正監督などの対応規制措置を実施した。不適合品の検査?管理、情報開示、リスクの手がかりの検証?処置などにより、製薬事業者に対する強い抑止力が形成され、医薬品のライフサイクル全体や全工程の品質管理に対する意識が強化されている。
二、抜取検査データの解析
(一)サンプリング状況
2023年の国家医薬品抜取検査では、化学薬品74品目、中成薬43品目、漢方飲片9品目、生物由来製品6品目を含む計132品目の製剤と漢方飲片がサンプリングされ、そのうち、国家必須医薬品48品目がサンプリングされた。サンプリングされたサンプルは合計18762ロットであり、その内訳は、生産プロセスが4272ロット、営業プロセスが13248ロット(インターネットプロセスでの207ロットを含む)、使用プロセスが1242ロット(図1を参照)であり、医薬品生産企業1114社、医薬品経営企業2528社、医薬品使用ユニット511社が関与した。このうち、オンライン抜取検査に参加した207ロットのサンプルはすべて規定を満たしていた。各省(区、市)のサンプリング状況と収集サンプルの表示生産会社の所在地のサンプリング分布をそれぞれ図2と図3に示す。

図1. 2023年国家医薬品抜取検査の各サンプリングプロセスにおけるサンプリング状況
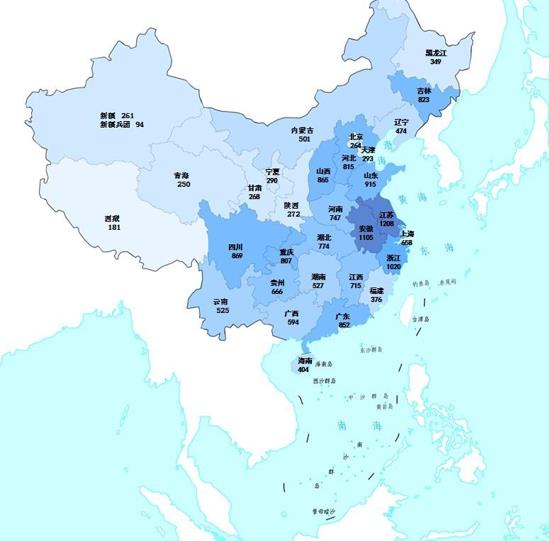
図2.2023年国家医薬品抜取検査のサンプル源の分布図
注:図内の数字は各省でサンプリングされたロット数を示しており、薄い色から濃い色までは、サンプリングされたロット数が少ない方から多い方を示している。

図3.2023年国家医薬品抜取検査のサンプルの産地分布図
(二)医薬品製剤の抜取検査データの解析
2023年には、国家医薬品抜取検査のために合計16604ロットの製剤製品がサンプリングされた。検査の結果、16531ロットの製品が規定に適合し、73ロットの製品が規定に適合しなかった。抜取検査が実施された123品目のうち、すべてのサンプルが規定に適合した製剤品目は106あり、合計13765ロットであった。そのうち、化学薬品は65品目9238ロット、中成薬は35品目4400ロット、生物由来製品は6品目127ロットであった。
1.化学薬品
2023年の国家医薬品抜取検査では、74品目の化学薬品(52品目の化学薬品、12品目の抗生物質、10品目の生化学的薬剤)の合計10893ロットがサンプリングされ、生産プロセスでは2436ロット、経営プロセスでは7606ロット、使用プロセスでは720ロット、インターネットプロセスでは131ロットが含まれた。検査の結果、10849ロットが規定に適合しており、44ロットが規定に適合していなかった。生産、経営、使用、インターネットで検出された不適合サンプルは2、40、2、0ロットで、 それぞれ対応するプロセスの全サンプルの0.1%、0.5%、0.3%、0.0%を占めた。(図4を参照)。
不適合項目には検査や含有量測定などが含まれており、不適合品数は9ロット、35ロットで、それぞれ不適合項目全体の20.5%、79.5%を占めた(図5を参照)。
2023年の国家医薬品抜取検査では、計13剤形の化学薬品が対象となり、計6剤形に規定を満たさないサンプルが含まれていた。そのうち、注射剤(2ロット)、錠剤(3ロット)、顆粒剤(33ロット)、軟膏剤(4ロット)、眼科用剤(1ロット)、経口液剤(1ロット)は、それぞれ対応する剤形の製品総数の0.1%、0.1%、9.1%、1.1%、0.4%、0.2%を占めた(図6を参照)。
抜取検査の結果は、生産企業が工場に入る原料を厳密に検査し、製造工程管理と主要な品質パラメータ管理を最適化し、滅菌プロセス、原薬?賦形剤の投入量、包装の安定性に焦点を当て、検査項目や検査指標に反映される問題点を徹底的に調査する必要があることを示唆している。経営企業は医薬品の保管?輸送プロセスの管理を強化し、温度と湿度の監視システムを改善し、冷暗所?冷蔵保管などの特殊な条件を必要とする医薬品に重点を置くべきである。監督管理部門は企業のバッチ生産記録を厳格に調査し、原料?添加物の投入量を検証し、品質基準の向上を促進することが推奨される。

図4.化学薬品各サンプリングプロセスの検査情報の模式図

図5.化学薬品不適合項目の分布図
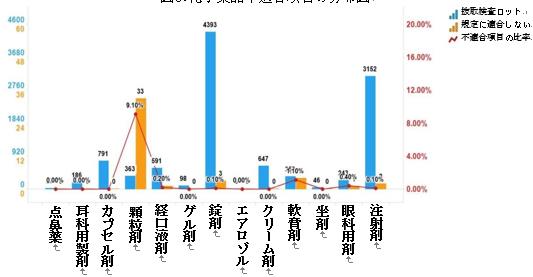
図6.化学薬品各剤形の検査情報の模式図
2.中成薬
2023年の国家医薬品抜取検査では、11剤形を含む43品目合計5584ロットの中成薬がサンプリングされ、生産、経営、使用、インターネットの各プロセスで、841ロット、4619ロット、48ロット、76ロットのサンプルが採取された。検査の結果、5555ロットが規定に適合しており、29ロットが適合しなかったが、これらはすべて経営プロセスで検出され、該当するプロセスの全サンプルの0.6%を占めた(図7を参照)。
不適合項目は主に確認と検査に関連しており、不適合品数は10ロット、19ロットで、それぞれ不適合項目全体の34.5%、65.5%を占めた(図8を参照)。
2023年の国家医薬品抜取検査では、11剤形の中成薬が含まれており、錠剤(16ロット)、丸剤(7ロット)、ペースト剤(4ロット)、シロップ(2ロット)を含む合計4つの剤形に不適合製品が検出され、それぞれ対応する剤形の全サンプルの1.2%、0.5%、2.4%及び0.7%を占めた(図9を参照)。
抜取検査の結果は、生産企業が主体責任の意識を強化し、医薬品原料の品質を厳格に管理し、医薬品原料の供給源からの品質を管理し、工場に入る医薬品原料を厳しく検査し、内部品質管理と生産管理レベルを強化し、主要な生産品質パラメータの管理を最適化する必要があることを示唆している。経営企業は医薬品の輸送及び保管プロセスの管理を改善する必要がある。中成薬の品質と有効性を確保するために、監督管理部門が生産企業に対する監督と検査を強化し、処方プロセスを厳格に遵守し、GMP規制を厳格に実施するよう促すことが推奨される。
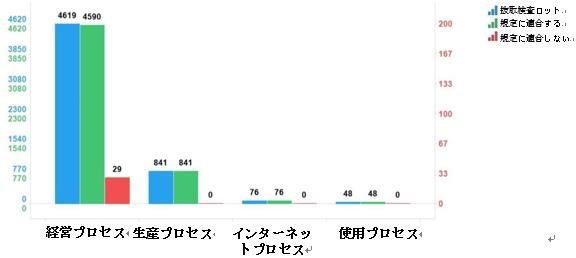
図7.中成薬各サンプリングプロセスの検査情報の模式図

図8.中成薬不適合項目の分布図
注:一部の不適合製品には、複数の不適合項目が含まれる。
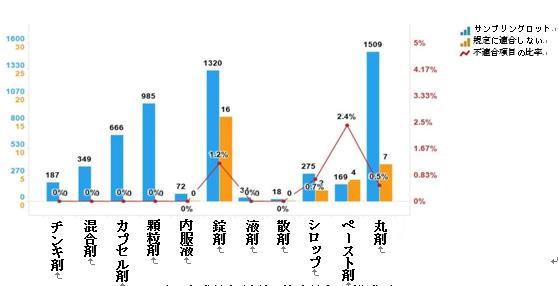
図9.中成薬各剤形の検査情報の模式図
3.生物由来製品
2023年の国家医薬品抜取検査では、6品目生物由来製品の合計127ロットがサンプリングされ、そのうち生産、経営、使用プロセスでそれぞれ50ロット、70ロット、7ロットのサンプルが採取された。その中には、5つの治療用品目と1つの予防用品目が含まれる。剤形は注射剤と体外診断用試薬である(図10を参照)。検査の結果、検査項目はすべて規定に適合しており、合格率は100%であった。
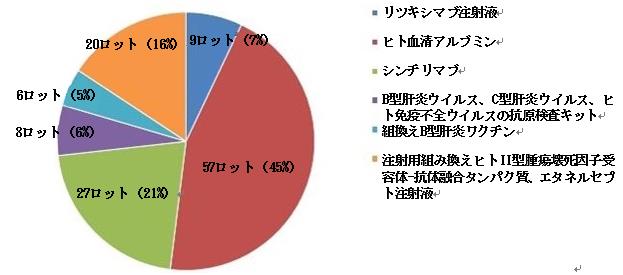
図10.生物由来製品のサンプリング品目情報の模式図
4.国家必須医薬品
2023年の国家医薬品抜取検査では、39品目の国家必須医薬品(漢方飲片を除く)合計6140ロットがサンプリングされ、生産、経営、使用、インターネットの各プロセスで、1570ロット、4120ロット、332ロット、118ロットのサンプルが採取された。検査の結果、13ロットが規定を満たしておらず、2つの剤形を含む製造及び経営プロセスで1ロットと12ロットの不適合製品が検出された。抜取検査の結果、国家必須医薬品の全体的な品質が良好であることが示された(図11を参照)
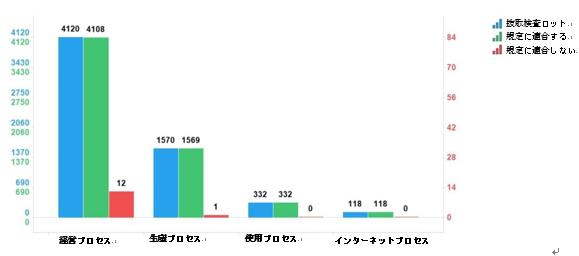
図11.国家必須医薬品各サンプリングプロセスの検査情報の模式図
5.国家医薬品集中調達選択品目
2023年の国家医薬品抜取検査では、20品目の国家医薬品集中調達選択品目合計3435ロットがサンプリングされ、生産、経営、使用、インターネットの各プロセスで、887ロット、2201ロット、290ロット、57ロットのサンプルが採取された。検査の結果、集中調達に含まれるサンプルは規定に適合することが確認された。抜取検査の結果、国家医薬品集中調達選択品目の全体的な品質が良好であることが示された(図12を参照)。

図12. 2023年国家医薬品集中調達選択品目の各プロセスにおけるサンプリング状況
6.輸入医薬品(輸入中薬材を除く)
2023年、国家医薬品抜取検査は、生産プロセスの11ロット、経営プロセスの257ロット、使用プロセスの41ロット(図14を参照)を含む、9つの剤形(図13を参照)を含む合計309ロットの輸入医薬品のサンプリングを実施した。検査の結果、検査項目はすべて規定に適合しており、合格率は100%であった。
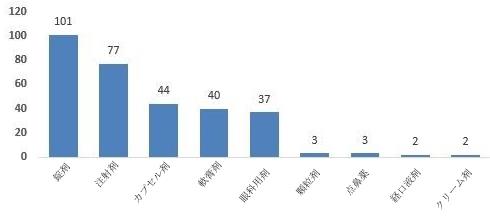
図13.輸入医薬品各剤形の検査情報の模式図
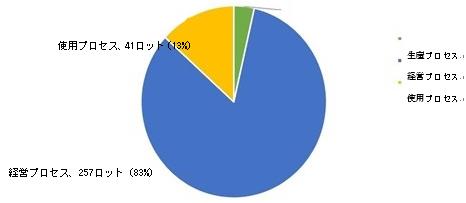
図14.輸入医薬品各サンプリングプロセスの検査情報の模式図
(三)漢方飲片の特別抜取検査と中薬材の品質監視
2023年、国家医薬品監督管理局は引き続き漢方飲片の特別抜取検査を実施した。年間を通じて9品目漢方飲片の合計2158ロット(処方顆粒234ロットと飲片1924ロットを含む)がサンプリングされ、染色、重量増加、粗悪品や偽造防止、不適切な栽培などの品質問題の可能性に焦点を当て、検査と探索的研究を実施した。検査の結果、2095ロットが規定に適合しており、63ロットが適合しなかった(図15を参照)。
不適合項目は主に、性状(4ロット)、薄層クロマトグラフィーによる確認(3ロット)、微生物限度(1ロット)、含有量測定(17ロット)、フィンガープリント(1ロット)、総灰分(9ロット)、水分 (37ロット)、酸不溶性灰分 (1ロット) に関するもので、それぞれ不適合項目全体の5.5%、4.0%、1.4%、23.3%、1.4%、12.3%、50.7%、1.4%を占めた。(図16を参照)
同時に、「中華人民共和国中医薬法」の関連要件を確実に実施するために、国家医薬品監督管理局は引き続き中薬材の品質監視を組織し、一部の医薬品生産企業、薬材市場流通センター、または植栽集中地域における中薬材の品質監視を組織する。2023年の中薬材の品質監視では、医薬品生産企業からの224ロット、市場流通センターまたは植栽集中地域からの27ロットを含む、9品目の合計251ロットのサンプルが監視された。すべてのサンプルは、さまざまな品目と対応する項目の特性に基づいて、主に粗悪品と偽造防止、加工炮製仕様、残留農薬などの問題に焦点を当てた研究試験を実施した。
2023年、漢方飲片の特別抜取検査と中薬材の品質監視で発見された主な問題点には以下がある。一つ目は、ホウ砂蚕を僵蚕(炒僵蚕)に混入し、理棗仁を酸棗仁に混入する問題。二つ目は、炒酸棗仁からカーマインが検出され、違法な染色の問題。三つ目は、外因性有害物質の過剰残留問題。一部の飲片には、マイコトキシン残留物、残留農薬、重金属、有害元素の過剰という隠れた危険性がある。例えば、麸炒薏苡仁の一部のロットではアフラトキシンとゼアラレノンが基準を超え、炒酸棗仁及び炒酸棗仁の処方顆粒の一部のロットではアフラトキシンB1が基準を超え、地骨皮の一部のロットから禁止されている農薬フルプロニル(Fipronil)が検出され、地骨皮の一部のロットでは重金属が一般的な制限要件を超え、丹参及び丹参の処方顆粒、甘草及び甘草の処方顆粒の一部のロットから植物成長調整剤などが検出される。四つ目は、不規範な収穫?加工及び加工?炮製の問題。例えば、酸棗仁や女貞子などは緑色になる前に収穫され、品質の低下につながり、地骨皮を生産する加工場の加工泥砂が完全に洗浄されていないなど、防己は産地から新鮮なまま加工される現象がある。
抜取検査と監視の結果は、我が国の漢方飲片の全体的な品質は良好であることを示している。しかし、漢方飲片の業界チェーン全体に参加する者は、品質に対する意識と責任感をさらに高める必要があり、漢方飲片生産企業は、全工程にわたる品質管理の意識を高める必要があり、第一に、医薬品原料のトレーサビリティとサプライヤーの資格審査管理を強化し、原材料の混入や有害物質の残留などの問題に焦点を当て、原料管理を適切に行う。第二に、生産前にプロセス検証を行い、生産中に炮製仕様を厳密に遵守する。第三に、検査と保管のプロセスを管理して、飲片の品質の信頼性と安定性を確保する。医薬品行政管理部門は医薬品上市許可保有者に対し、工程手順及び購入した医薬品原料の品質を厳格に管理するよう促し、引き続き中薬材と飲片の市場監視を強化する必要がある。
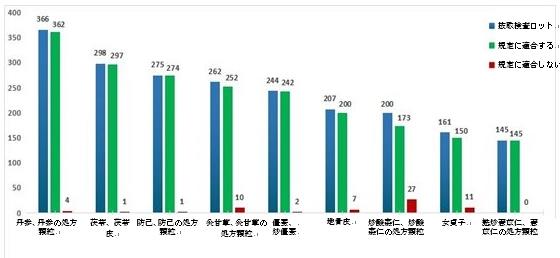
図15.2023漢方飲片の特別抜取検査結果
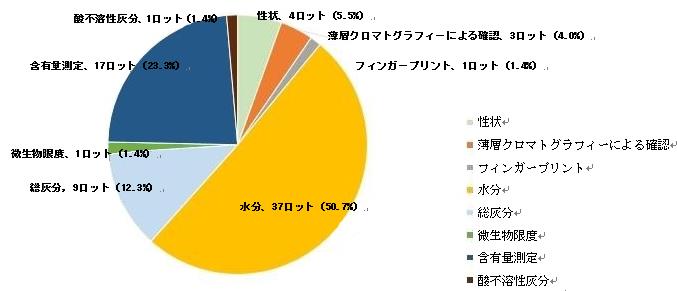
図16. 2023年漢方飲片の特別抜取検査における不適合項目の分布図
注:一部の不適合製品には、複数の不適合項目が含まれる。
(四)探索的研究
2023年には、長年の技術的蓄積に基づいて、各医薬品検査機関は法定の医薬品標準法と探索的研究法の試験を同等に重視し、探索的研究ツールを最大限に活用し、医薬品の品質の安定性と現行の規格の実現可能性を包括的に検討すると同時に、考えられる潜在的なリスクを調査し、医薬品の品質基準を向上させ、監督と管理のレベルを向上させるために科学的で信頼できる技術サポートを提供する。発見された主な問題は次のとおりである。
一つ目は、漢方飲片の混用と異物混入の問題、偽造、異物混入の中薬材と漢方飲片を使用して漢方薬製剤を製造する問題が依然として存在すること。二つ目は、個別企業による違法生産の問題が依然として存在すること、例えば、許可なく製造工程を変更する、制限値を下げる、または混ぜ物や代替材料を使用する、重要なプロセス製造法に違反する、許可なく賦形剤、保存料、静菌剤を変更又は追加するなど。三つ目は、原材料の品質の違いと不安定な生産プロセスにより、メーカーごとに製品の均一性が悪くなること。四つ目は、外因性有害物質が基準値を超え、一部の品目では重金属、農薬、マイコトキシンなどの残留量が制限値を超えていること。五つ目は、包装材料の適合性の問題が製品の品質と安定性に影響を及ぼすこと。
三、抜取検査結果の応用
医薬品抜取検査は、医薬品監督の重要な手段として、医薬品の品質リスクの発見や法令違反の取り締まりにおいてかけがえのない役割を果たしており、科学的監督と厳格な監督を実現するための重要な技術的なサポートである。国家医薬品抜取検査の目的は、リスクを管理し、生産を標準化し、医薬品の品質と安全性を確保することだけではなく、その結果を積極的に活用することは、医薬品の品質を継続的に向上させ、業界のアップグレードを促進するための重要な方法である。
(一)政策支援の推進と抜取検査システムの構築改善
国家医薬品監督管理局は、より科学的な抜取検査業務を推進するため、抜取検査制度の構築とトップレベルのデザインを引き続き強化している。2023年には、「地方医薬品抜取検査の更なる改善に関する通知」を発行し、地方抜取検査のより明確かつ具体的な要件を提示し、国と地方の抜取検査の連携と補完性を強化する。引き続き医薬品抜取検査制度の最適化と革新を推進し、抜取検査の作業メカニズムと作業手順を改善し、「医薬品抜取検査の探索的研究の原則と手順」の改定を推進し、探索的研究の実施を規範化させ、指導する。「医薬品サンプリング原則と手順」を改訂し、中薬材及び漢方飲片のサンプリングとサンプル調製方法を洗練及び改善し、オンラインでのサンプリングとサンプル購入の方法と手段を検討する。医薬品監督の実際のニーズに応える能力を向上させるための取り組みが行われる。
(二)社会的ホットスポットに注目、特別なリスク監視を積極的に実施
近年、医薬品の安全性に関する緊急事態が世間やメディアの注目を集めており、検出?分析技術の急速な発展により、市販されている一部の成熟医薬品の未公開の品質と安全性の問題が徐々に明らかになってきている。社会的ホットスポット、潜在的なリスクポイント、規制上の困難に焦点を当てた主要な国家医薬品政策の実施に関連して、国家医薬品抜取検査は毎年異なる特別プロジェクトを設定し、国家集中調達、小児用医薬品、生物由来製品などから選定した重点品目について特別研究を実施し、科学的監督に対する技術支援を提供する。潜在的なリスクポイントに対応して、2023年にはアリストロキン酸研究、残留溶媒研究、オンライン抜取検査などの特別プロジェクトが立ち上げられ、潜在的なリスクは効果的に管理されている。例えば、海外でのシロップ中のエチレングリコール?ジエチレングリコール汚染の報告について、残留溶剤の調査を実施した。特別プロジェクトの研究成果の中には、国際的にも認められているものもあり、例えば、残留溶媒研究に関する研究成果は「国際薬局方」に掲載されている。
(三)偽造?規格外医薬品に対する綿密なリスク調査と管理
2023年、国家医薬品監督管理局は「リスク管理-法に基づく処置-原因調査と是正-情報開示」という監督モデルに従い、リスクの終結を確実にし、医薬品の安全性を警告する。国家医薬品抜取検査で不適合と判明した製品136ロットについて、封印?押収、販売や使用の停止、企業の自主回収などのリスク管理措置を直ちに講じるよう、各省レベルの医薬品監督管理部門を組織する。関与した関連企業及び部門は調査され、法に従って処罰される。同時に、医薬品生産企業は、品質と安全性の危険を迅速かつ効果的に排除するために、厳重な検査を実施し、問題の原因を特定し、実際的な是正を行うよう促すことが求められている。医薬品抜取検査を通じて、偽薬や粗悪品の生産と販売を取り締まり、悪徳企業を抑止し、市場環境を浄化する役割を果たす。さらに、国家医薬品監督管理局は2023年、合計4つの医薬品の補足試験方法を発表し、極めて密かな異物?偽物混入などの犯罪に対抗する規制手段を提供するとともに、企業が医薬品の品質と安全性を確保するための科学的根拠を提供した。
(四)リスクアラートの深化と規制へのサービスの統合
製造工程、処方、原薬?賦形剤、包装材料、説明書などに関する探索的研究で特定された一般的な問題について、医薬品監督管理部門は「医薬品品質注意書」という形で関連企業にフィードバックし、企業の製品品質に対する意識を高め、企業の主体責任の履行を強化する。例えば、ベタヒスチン二塩酸塩錠の探索的研究では、一部の企業で湿式造粒後の過度の乾燥時間がスクロース含有量に影響を与える可能性があることが判明し、製造工程のパラメーターを最適化する必要があることが示唆された。また、止咳寧嗽カプセルの探索的研究では、一部のロットでアミグダリンの含有量が低いことが判明し、企業は原薬の品質管理を強化する必要があることが示唆された。
関連企業は自主的に内部統制規格の改訂、工程の改善、サプライヤー監査の強化、添付文書の改訂などの修正措置を講じ、製品の品質水準を向上させる。各省局は多部門連合会議により、企業との事実確認の聞き取り、リスクコミュニケーション、追跡検査などの方式で、警告情報による企業に対する監督?指導を強化する。サービスにより監督管理を実現するというリスク警告により、監督管理部門、医薬品検査機構と企業との間の信頼及び理解を深め、上市許可保有者主体の責任の確実な履行を促進し、自主調査、予防ファーストの監督管理方式の有益な探索である。
(五)情報の適時開示、スマート監督管理の支援
国家医薬品監督管理局は、法律に従って、通達で規定に適合しない医薬品の抜取検査情報を大衆に適時に警告を与え、大衆の医薬品使用の安全の防衛ラインをを構築し、2023年に計7期の医薬品の抜取検査の通達を公布し、全部の規定に適合しない医薬品及び関連企業を法律に従って開示し、違法な企業を畏怖させ、医薬品の安全使用を警告した。中国食品医薬品検定研究院は、公式サイトで国家医薬品の抜取検査の探索的研究結果を継続して公開し、2023年に計39品目の新たに作成した検査方法を公布した。情報の共有及び利用により、医薬品上市許可保有者及び関連製造経営企業の品質安全意識及び主体責任の自律意識をさらに促進し、医薬品の品質のリスク管理能力を向上させ、製品の研究開発の革新及び向上を促進する。
四、結論
2023年の国家の医薬品抜取検査業務を成功裏に完了させる。検査及び研究の結果により、中国の医薬品の品質は依然として高いレベルにあり、全体的な安全状況は安定しより良くなる。
2024年は中華人民共和国成立75周年にあたり、「十四五」計画の実施にとっても重要な1年であり、国家医薬品監督管理局は習近平総書記による医薬品の監督管理業務に対する重要な指示?指導を誠実に実施し、「四つの厳しい」要求は各具体的な監督管理の実践に徹底的に実施し、さらにリスク認識を強化し、、医薬品の安全性のボトムラインを断固として守り、医薬品監督管理効率を向上させ、科学的、効率的、権威のある医薬品の上市後の監督管理体系の構築を加速化し、中国の製薬大国から製薬強国への飛躍を促進し、人々の医薬品の安全使用をよりよく保障する。
ヒント
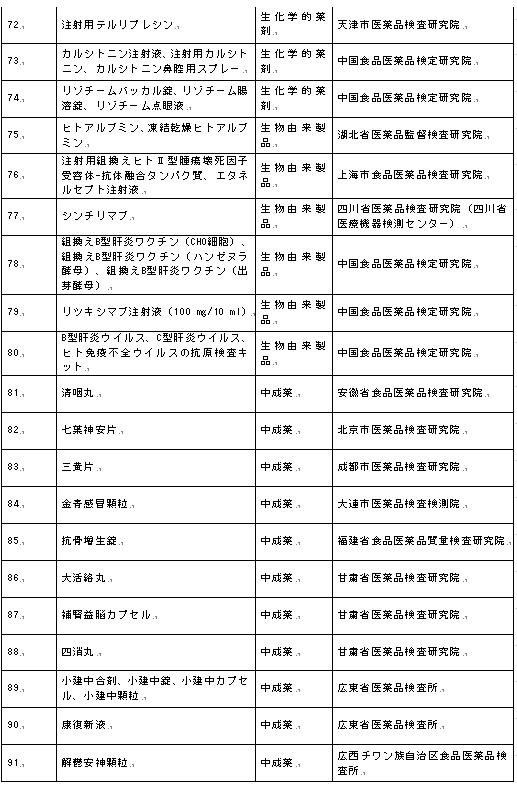
1.医薬品の抜取検査の歴史
1956年、中国は初めて医薬品の抜取検査方式の概念を提案した。1964年、元衛生部は国家レベルの年度の抜取検査計画を初めて作成しその実施を組織した。1984年、「中華人民共和国医薬品管理法」を公布し、法律において医薬品の抜取検査業務の地位を如実に表した。1986年、医薬品の品質公報体系を実行した。1990年、医薬品の抜取検査の課金制度、即ち、抜取検査の医薬品は、抜取検査対象企業により検査手数料を払わなければならない。2001年、「中華人民共和国医薬品管理法」を改訂し、医薬品の抜取検査の課金制度をキャンセルし、必要な費用は財政支出に含めた。2019年、「中華人民共和国医薬品管理法」を再改訂し、「医薬品の監督管理部門は監督管理のニーズに応じて、医薬品の品質に対して抜取検査を行う」、「抜取検査はサンプルを購入しなければならない」を明確にした。
2.医薬品規格検査
医薬品規格検査とは、検査資格のある医薬品検査機関が、国家医薬品監督管理部門により承認された法定検査規格における検査方法に従って、全数検査又は抜取検査を行い、法律に従って検査報告書を発行する過程を指す。
3.探索的研究
探索的研究とは、医薬品の抜取検査において、医薬品規格に従って検査し医薬品が規格規定に適合するか否かを判定することを除き、監督管理業務のニーズに応じ、さらに抜取検査されたサンプルが存在する可能性がある品質リスクに対して、医薬品規格以外の検査項目及び検査方法を採用して医薬品品質をさらに分析?研究する過程を指し、潜在的なリスクと危険を予防?管理し、医薬品の品質水準を向上させ、医薬品の監督管理を強化するために技術的支援を提供することができる。
4.国家必須医薬品
国家必須医薬品とは、医療衛生の基本的ニーズに合わせ、剤形が適切で、価格が合理的で、供給を保障することができ、大衆が公平に取得することができる医薬品を指す。国家必須医薬品目録は、各レベルの医療?衛生機関の医薬品の配置及び使用の根拠となるものである。「国家必須医薬品目録(2018年版)」における医薬品は、化学薬品及び生物由来製品、中成薬、漢方飲片の3部分を含み、そのうち、化学薬品及び生物由来製品は主に臨床薬理学に従って分類し、計417品目である。中成薬は主に機能に従って分類し、計268品目である。漢方飲片は、具体的な品目をリストアップせず、国家規格を発行した漢方飲片は国家必須医薬品で、国家の別の規定がある場合を除く。
5.医薬品の補充検査方法
医薬品の補充検査方法及び検査項目(医薬品の補充検査方法)は、模倣品や粗悪品を混ぜる疑いのあり、且つ国家医薬品規格で規定された検査方法及び検査項目により検査できない医薬品の検査に適用される。国務院医薬品監督管理部門により承認した後、補充検査方法及び検査項目を使用して得られた検査結果は、医薬品監督管理部門が医薬品の品質を鑑定するための根拠とすることができる。
6.検査項目
性状項目で記載された外観、匂い、味、溶解度及び物理定数などは、医薬品の品質の特性をある程度反映する。
確認項目で規定された検査方法は、この医薬品のある物理的、化学的又は生物学的特性を反映するために行われた確認検査で、この医薬品の化学的構造の確認を完全に代表するものではない。
検査項目には、医薬品の安全性と有効性を反映した検査方法及び限度、均一性及び純度などの調製工程の要求事項などの内容が含まれる。規定における様々な不純物の検査項目に対して、この医薬品は、既存の工程に従って製造及び正常な保存過程で含有又は生成する可能性があり且つ管理する必要がある不純物(例えば、残留溶媒、類縁物質など)を指す。製造工程を変更する場合にさらに関連項目を追加?修正しなければならない。
含有量測定項目で規定された検査方法は、原材料及び製剤における活性成分の含有量の測定に用いられ、一般的に化学的、装置的又は生物的測定方法を使用することができる。


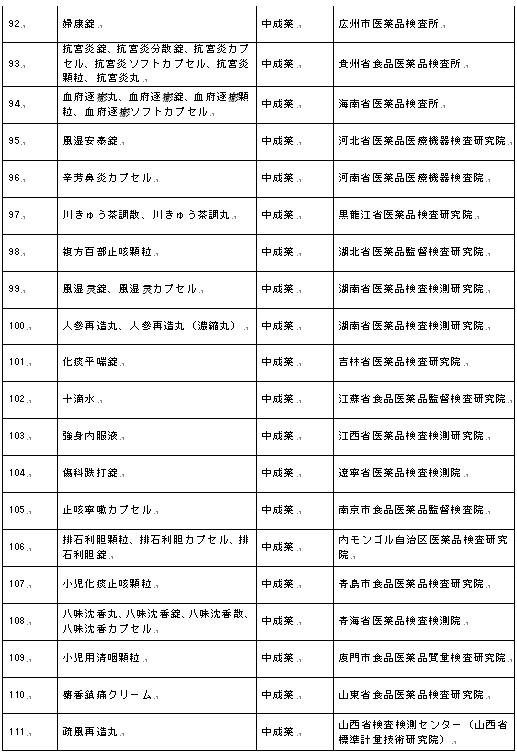

(出所:国家医薬品監督管理局サイト2024-03-26)



 ホーム
ホーム 最新情報
最新情報 機構紹介
機構紹介 国際交流
国際交流 サイトについて
サイトについて